В останні роки завдяки досягненням в галузі молекулярної і клітинної біології вдалося розшифрувати багато механізмів патогенезу різних захворювань, включаючи онкологічні та аутоімунні. Зокрема, вдалося визначити ознаки злоякісного фенотипу: чутливість щодо ростових сигналів, толерантність до зростання-ігібіторним сигналам, захист від програмованої клітинної смерті (апоптозу), необмеженість репликативного потенціалу, ангіогенез, тканинна інвазія і метастазування. Поява цих даних стало стимулом для пошуку принципово нових методів терапії, точково, прицільно впливають на ключові ланки патогенетичної ланцюга патологічного процесу, які отримали в зв'язку з цим загальна назва «таргетная терапія».
Використання моноклональних антитіл в якості терапевтичних агентів стало для медицини стратегічним етапом у зміні концепції лікування - від неспецифічної до специфічної (таргетной) терапії. Розробка моноклональних антитіл направлена на ідентифікацію і взаємодію одержуваних агентів зі специфічними клітинними мішенями або сигнальними шляхами, що в підсумку повинно приводити до клітинної смерті за допомогою різних механізмів. Моноклональні антитіла, на відміну від традиційних препаратів, високоспецифічні до певних мішенях. На сьогоднішній день вони найбільш активно використовуються в онкогематології і лікуванні солідних пухлин і аутоімунних захворювань. Раніше основна увага приділялася цитолитических дії моноклональних антитіл шляхом стимуляції імунної відповіді. Останнім часом основна увага зосереджена на ключових мішенях, що беруть участь в регуляції росту пухлинних клітин і спрямованої доставки цитотоксичних агентів. В даний час показано, що використовуються терапевтичні антитіла крім прямої дії виконують іммуноопосредованних ефекторні функції, включаючи антителозависимую і комплемент-залежну цитотоксичність.
Таким чином, моноклональні антитіла можуть сприяти активації опухолеспеціфіческіх імунної відповіді.
В даний час FDA схвалений до застосування цілий ряд препаратів, що містять моноклональні антитіла (табл. 1). Фармацевтичні компанії активно проводять клінічні випробування з метою розширення показань щодо застосування дозволених препаратів.
Моноклональні антитіла, дозволені FDA
Рецептор глікопротеїдів IIb / IIIa
Гострий коронарний синдром
Фактор некрозу пухлини-a
Запальні захворювання (головним чином, аутоімунні)
Хронічний лімфоцитарний лейкоз
Рецептори IL-2 a
Фактор росту ендотелію судин
Рецептор епідермального фактора росту
Рецептори IL-2 a
Система комплементу C5
Запальні захворювання, включаючи параксизмальной гемоглобинурию
Адгезивний рецептор CD11a
Запальні захворювання (псоріаз)
Неходжкінські лімфоми (з ibrium-90 або indium-111)
Фактор некрозу пухлини-a
Запальні захворювання (головним чином, аутоімунні)
Адгезивний рецептор VLA4
Імуно-запальні захворювання (головним чином, аутоімунні, і першу чергу, розсіяний склероз)
Імуноглобулін Е (IgE)
Імуно-запальні захворювання (головним чином астма)
Епітоп протеїну f RSV
Вірусна інфекція (респіраторний синцитіальним вірус (RSV)
Рецептор епідермального фактора росту
Фактор росту ендотелію судин
Рецептор епідермального фактора росту
Рак молочної залози
Однак якщо при застосуванні Rituximab (Rituxan / MabThera) для лікування В-клітинних неоплазий підтверджена не тільки ефективність, але і безпеку, то мета-аналіз використання інгібіторів цитокінів та ростових факторів (в якості ключових мішеней) дає не настільки позитивну картину.
Розвиток подібних ускладнень цілком прогнозовано. Клітини імунної системи та інші соматичні клітини взаємодіють між собою за допомогою широкого спектру медіаторів, зокрема цитокінів та ростових факторів. Ця взаємодія носить характер каскадних реакцій і регуляції по типу зворотного зв'язку. Розвиток патологічного процесу порушує тонкий баланс, викликаючи дисрегуляцию міжклітинних взаємодій, яке проявляється у вигляді імунозапальних і аутоімунних процесів, пухлинного росту і т.д.
На прикладі відомих механізмів дії фактора некрозу пухлини-альфа (TNFalfa) ми спробували сформулювати вимоги, що пред'являються до терапевтичних засобів, що блокують TNF, і оцінити відповідність анти-TNF терапевтичних антитіл (ТАТ) цим вимогам.
Найбільш докладно досліджений перший, що полягає у взаємодії TNF і трансмембранного рецептора TNF-R1 (p55). Не вдаючись в особливості структурно-функціональних властивостей взаємодіючих молекул, відзначимо, що зв'язування TNF з рецептором TNF-R1 викликає активацію останнього. Залежно від типу і стану клітин, а також микроокружения активація TNF-R1 призводить до реалізації одного з можливих сигнальних шляхів (рис. 1).
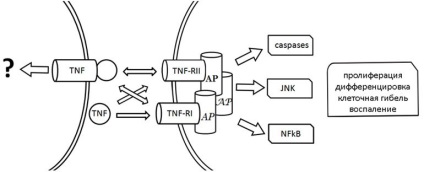
Малюнок 1. Схема TNF-залежних сигнальних шляхів. TNF-RI і TNF-RII рецептори TNF, AP - Адапторная білки
У разі цитотоксической сигналізації показано, що фізична асоціація TNF-R1 з Адапторная білками TRADD / FADD запускає т.зв. каспазний каскад (активацію протеолітичних ферментів), що в переважній більшості випадків завершується деградацією різноманітних внутрішньоклітинних мішеней, включаючи ядерну ДНК, і загибеллю клітин. Взаємодія TNF-R1 з іншими Адапторная білками (TRAF2, RIP, NIK, FAN і ін.) Може стимулювати активацію різноманітних внутрішньоклітинних білків, зокрема, транскрипційного фактора NF-ĸB, кінази JNK, каспаз, сфінгомієлінази і ін. На клітинному рівні активація TNF -R1 може викликати загибель, проліферацію і диференціювання клітин. Крім того, встановлено, що активація TNF-R1 впливає на такі морфогенетические ознаки, як рухливість і форма клітин, міжклітинні контакти.
Взаємодія TNF і трансмебранного TNF-R2 (p75) є ще одним видом прояви клітинних ефектів TNF (рис. 1). Вважається, що на відміну від TNF-R1, здатного активуватися при зв'язуванні як мTNF, так і рTNF, TNF-R2 активується насамперед мTNF. Відповідно, освіту комплексу рTNF-TNF-R2 розглядається як спосіб збільшення локальної концентрації рTNF на клітинній мембрані для подальшої передачі його на TNF-R1 ( «ligand-passing») і / або як засіб часткового / конкурентного блокування взаємодії мTNF і TNF-R2. Як і в разі TNF-R1, активоване TNF-R2 здатний утворювати асоціати з різними Адапторная білками (TRAF1, TRAF2, RIP, FADD) і таким чином ініціювати активацію тих чи інших сигнальних шляхів, викликаючи загибель або проліферацію клітин.
Загальна картина клітинних ефектів TNF ускладнюється ще й давно відомим фактом, що лімфотоксин-alfa (LTalfa), інший цитокін сімейства TNF, здатний взаємодіяти з рецепторами чинника некрозу пухлин. Таким чином, TNF може впливати на функціонування ще одного цитокіну, регулюючи його зв'язування і активацію.
Фізіологічні прояви активності TNF надзвичайно широкі. Тут ми наведемо лише деякі приклади дії TNF.
У разі ж системного блокування TNF, як це робиться в даний час, наприклад, при терапії аутоімунних захворювань, слід очікувати різкого зниження концентрації розчинного TNF в крові пацієнта і блокування трансмембранної форми цитокина. Прозапальні ефекти TNF тимчасово будуть придушені, буде також блокована TNF-залежна гіперплазія сіновіоцітов, якщо така є, наприклад при ревматоїдному артриті. Разом з тим інгібування запальних процесів на рівні ТNF залишає організм практично з «виключеною» імунною системою з усіма витікаючими наслідками, до того ж добре відомими; придушення TNF-залежного апоптозу збільшує ймовірність збереження і розмноження трансформованих клітин і т.д. закінчуючи збільшенням ваги пацієнта і перманентної сонливістю.
Таким чином, застосовувана терапія на основі анти-TNF ТАТ абсолютно не відповідає пропонованим критеріям (див. Вище). Блокуючи одне з «ключових» ланок патологічного процесу, бажаний ефект досягається в кращому випадку тимчасово, оскільки включаються допоміжні «неключових» чинники, причому на тлі серйозних небажаних реакцій. Тому терапія моноклональними антитілами, незважаючи на її комерційну привабливість, на наш погляд, не є перспективним напрямком при тривалому лікуванні. Очевидно, це розуміють і розробники нових ЛЗ.
Сучасні протоколи вже засновані на комбінованому підході до лікування, включаючи вакцини, хіміотерапію, моноклональні антитіла. В основі такого підходу лежить передбачуваний терапевтичний синергізм. Крім того, розглядається можливість застосування рекомбінантних пептидних лігандів, кон'югованих з проникаючими всередину клітини цитотоксинів, низькомолекулярних інгібіторів, здатних впливати на внутрішньоклітинний домен рецепторів і переривати процес сигнальної трансдукції, малих РНК (iPNA). Ідентифікація стовбурових клітин в різних видах пухлин відкриває нові мішені, відповідальні за їх прогресування і метастазування.
Таким чином, тільки комплексний підхід, що враховує різні патогенетичні ланки і різні класи препаратів, здатний забезпечити необхідний ефект з мінімальним ризиком для пацієнта.