Металева зв'язок - тип зв'язку атомів в кристалічних речовинах, що володіють металевими властивостями (металах, Металлиди). М. с. обумовлена великою концентрацією в таких кристалах квазівільні електронів (електронів провідності). Негативно заряджений електронний газ «пов'язує» позитивно заряджені ті в.о. ни один з одним.
Ковалентний зв'язок - один з видів хімічного зв'язку між двома атомами, яка здійснюється загальною для них електронної парою (по одному електрону від кожного атома). К. с. існує як в молекулах (в будь-яких агрегатних станах), так і між атомами, що утворюють решітку кристала. К. с. може пов'язувати однакові атоми (в молекулах H2. Cl2. в кристалах алмазу) або різні (в молекулах води, в кристалах карборунда SiC). Майже всі види основних зв'язків в молекулах органічних сполук є ковалентними (С - С, С - Н, С - N і ін.). К. с. дуже міцні. Цим пояснюється мала хімічна активність парафінових вуглеводнів. Багато неорганічні сполуки, кристали яких мають атомну решітку, тобто утворюються за допомогою К. с. є тугоплавкими, мають високу твердість і зносостійкість. До них належать деякі карбіди, силіциди, бориди, нітриди (зокрема, відомий боразон BN), що знайшли застосування в новій техніці.
Іонна зв'язок - електровалентная зв'язок, гетеровалентності зв'язок, один з видів хімічного зв'язку, в основі якого лежить електростатична взаємодія між протилежно зарядженими іонами. Такі зв'язку в порівняно чистому вигляді утворюються в галогенидах лужних металів, наприклад KF, так як атоми лужних металів мають по одному слабо утримується електрону (енергія зв'язку приблизно 3-5 ев), а атоми галогенів володіють найбільшим спорідненістю до електрону. Але навіть в кристалах (і тим більше в молекулах) цих сполук повної передачі електрона від атома металу атому галогену здебільшого все ж не відбувається. Поширені перш уявлення про освіту в інших випадках двох-, трьох- або четирехзарядних іонів Ca 2+. C 2. B 3+. Si 4+ не підтвердилися, так як хімічний зв'язок утворюється в таких випадках більш складним шляхом. Для оцінки ступеня ионности зв'язку користуються поняттям ефективного заряду іона.
Вихідна структура високовуглецевого інструментальної сталі У11 до нагрівання під загартування - перліт + карбіди.
Критичні точки для стали У11: А c 1 = 730 ºС. А cm = 810ºС.
Оптимальний режим нагріву під загартування для заевтектоідних сталей (% С> 0,8%) становить АС 1 + (30 ÷ 50º), тобто для У11 - 760- 780ºС. При цьому після гарту маємо дрібне зерно, що забезпечує найкращі механічні властивості стали У11.
Нагрівання і витримка стали У11 при температурі 850 ° С перед загартуванням призводить до зростання зерна і погіршення механічних властивостей стали після термічної обробки. Грубозерниста структура викликає підвищену крихкість сталі. іноді призводить до тріщин.
Загартування доевтектоїдної стали полягає в нагріванні стали до температури вище критичної (Ас3), в витримці і наступному охолодженні зі швидкістю, що перевищує критичну.
Температура точки Ас3 для стали 30 становить 820 ° С.
Термічною обробкою, необхідної для отримання твердості 350 НВ, є ізотермічна гарт на троостіт. В якості охолоджуючої середовища при ізотермічної загартування найчастіше застосовують розплавлені солі, інтервал температур яких визначається експериментально.
При нагріванні стали У8 вище А 1 перліт переходить в аустеніт. В результаті охолодження в розплавах солей з аустеніту утворюється феритної-цементітная структура - троостіт.
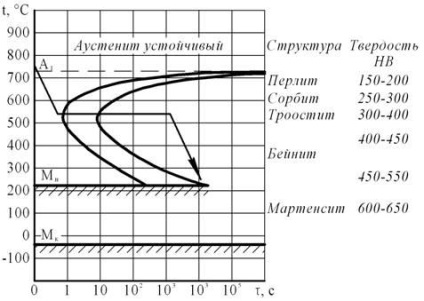
Малюнок 6 - Діаграма ізотермічного перетворений ия ау стеніта стали У8
В результаті термічної обробки виходить твердість стали 350 НВ, структура - троостіт.
Первинна кристалізація сплавів системи залізо-вуглець починається після досягнення температур, відповідних лінії ABCD (лінії ликвидус), і закінчується при температурах, що утворюють лінію AHJECF (лінію солидус).
При температурах, відповідних лінії ВС, з рідкого розчину кристалізується аустеніт. У сплавах, що містять від 4,3% до 6,67% вуглецю, при температурах, які відповідають лінії CD. починають виділятися кристали цементиту первинного. Цементит, кристалізується з рідкої фази, називається первинним. B точці С при температурі 1147 ° С і концентрації вуглецю в рідкому розчині 4,3% утворюється евтектика, яка називається ледебуріта. Евтектичну перетворення з утворенням ледебуріта можна записати формулою ЖР4,3 Л [А2,14 + Ц6,67]. Процес попередньої кристалізації чавунів закінчується по лінії ECF освітою ледебуріта.
Таким чином, структура чавунів нижче 1147 ° С буде: доевтектичних - аустеніт + ледебурит, евтектичних - ледебурит і заевтектичних - цементит (первинний) + ледебурит.
Перетворення, що відбуваються в твердому стані, називаються вторинної кристалізацією. Вони пов'язані з переходом при охолодженні γ-заліза в α-залізо і розпадом аустеніту.
Лінія GS відповідає температурам початку перетворення аустеніту в ферит. Нижче лінії GS сплави складаються з фериту і аустеніту.
Лінія Е S показує температури початку виділення цементиту з аустеніту внаслідок зменшення розчинності вуглецю в аустеніт з пониженням температури. Цементит, що виділяється з аустеніту, називається вторинним цементитом.
У точці S при температурі 727 ° С і концентрації вуглецю в аустеніт 0,8% утворюється евтектоїдна суміш складається з фериту і цементиту, яка називається перлітом. Перліт виходить в результаті одночасного випадання з аустеніту частинок фериту і цементиту. Процес перетворення аустеніту в перліт можна записати формулою А0,8 П [Ф0,03 + Ц6,67].
Лінія PQ показує на зменшення розчинності вуглецю в фериті при охолодженні і виділення цементиту, який називається третинним цементитом.
Отже, сплави, що містять менш 0,008% вуглецю (точка Q), є однофазними і мають структуру чистого фериту, а сплави, що містять вуглець від 0,008 до 0,03% - структуру ферит + цементит третинний і називаються технічним залізом.
Доевтектоїдних стали при температурі нижче 727ºС мають структуру ферит + перліт і заевтектоідние - перліт + цементит вторинний в вигляді сітки по межах зерен.
У доевтектичних чавунах в інтервалі температур 1147-727ºС при охолодженні з аустеніту виділяється цементит вторинний, внаслідок зменшення розчинності вуглецю (лінія ES). Після досягнення температури 727ºС (лінія PSK) аустеніт, збіднений вуглецем до 0,8% (точка S), перетворюючись в перліт. Таким чином, після остаточного охолодження структура доевтектичних чавунів складається з перліту, цементиту вторинного і ледебуріта перетвореного (перліт + цементит).
Структура евтектичних чавунів при температурах нижче 727ºС складається з ледебуріта перетвореного. Заевтектичних чавун при температурах нижче 727ºС складається з ледебуріта перетвореного і цементиту первинного.
Правило фаз встановлює залежність між числом ступенів свободи, числом компонентів і числом фаз і виражається рівнянням:
C = K + 1 - Ф,
де С - число ступенів свободи системи;
К - кількість компонентів, що утворюють систему;
1 - число зовнішніх факторів (зовнішнім фактором вважаємо тільки температуру, так як тиск за винятком дуже високого мало впливає на фазовий рівновагу сплавів в твердому і рідкому станах);
Ф - число фаз, що знаходяться в рівновазі.
Сплав заліза з вуглецем, що містить 0,01% С, називається доевтектоїдної сталлю. Його структура при кімнатній температурі - Ферит + Цементит (первинний).
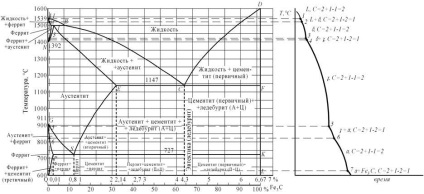
Малюнок 5. а-діаграма залізо-цементит,
б-крива охолодження для сплаву, що містить 0,01% вуглецю