Сучасна промислова технологія отримання етилового спирту з харчової сировини включає наступні стадії:
§ Підготовка та подрібнення крахмалистого сировини - зерна (перш за все - жита, пшениці), картоплі, кукурудзи і т. П.
§ Ферментація. На цій стадії відбувається ферментативне розщеплення крохмалю до зброджуваний цукрів. Для цих цілей застосовуються рекомбінантні препарати альфа-амілази, отримані біоінженерних шляхом - глюкамілаза, амилосубтилин.
§ Бродіння. Завдяки сбраживанию дріжджами цукрів відбувається накопичення в брагу спирту.
§ брагоректифікації. Здійснюється на розгінних колонах.
Відходами бродильного виробництва є вуглекислий газ, барда, ефіро-альдегидная фракція, сивушний спирт і сивушні масла.
Продуктивність сучасного спиртового заводу близько 30 000-100 000 літрів спирту на добу.
У промислових масштабах етиловий спирт отримують з сировини, що містить целюлозу (деревина, солома), яку попередньо гідролізують. Утворену при цьому суміш пентоз і гексоз піддають спиртовому бродінню. У країнах Західної Європи і Америки ця технологія не набула поширення, але в СРСР (нині в Росії) існувала розвинена промисловість кормових гідролізних дріжджів і гідролізного етанолу.
У промисловості, поряд з першим способом, використовують гідратацію етилену. Гідратацію можна вести за двома схемами:
§ пряма гідратація при температурі 300 ° C, тиску 7 МПа, як каталізатор застосовують ортофосфорну кислоту, нанесену на силікагель, активоване вугілля або азбест:
§ гідратація через стадію проміжного ефіру сірчаної кислоти, з подальшим його гідролізом (при температурі 80-90 ° С і тиску 3,5 МПа):
Ця реакція ускладнюється утворенням діетилового ефіру.
Етанол, отриманий шляхом гідратації етилену або бродінням, являє собою водно-спиртову суміш, яка містить домішки. Для його промислового, харчового і фармакопейного застосування необхідне очищення. Фракційна перегонка дозволяє отримати етанол з концентрацією близько 95,6% (мас.); ця нероздільна перегонкою азеотропная суміш містить 4,4% води (мас.) і має температуру кипіння 78,15 ° C.
Перегонка звільняє етанол як від легколетких, так і від важких фракцій органічних речовин (кубовий залишок).
Абсолютний спирт - етиловий спирт, практично не містить води. Він кипить при температурі 78,39 ° C, в той час як спирт-ректифікат, що містить не менше 4,43% води, кипить прі78,15 ° C. Одержують перегонкою водного спирту, що містить бензол, і іншими способами.
Зовнішній вигляд: в звичайних умовах являє собою безбарвну летючу рідину з характерним запахом і пекучим смаком. Етиловий спирт легше води. Є хорошим розчинником інших органічних веществ.Следует уникати популярної помилки: часто змішують властивості 95,57% спирту і абсолютизації. Їх властивості майже однакові, але величини починають різнитися, починаючи з 3 - 4-й значущої цифри.
Взаємодіє з лужними металами з утворенням етілат (або в загальному випадку - алкоголятов) і водню.
Реагує з карбоновими кислотами з утворенням складних ефірів:
Вступає в реакцію дегідратації в присутності сірчаної кислоти (при 120 ° C) з утворенням діетилового ефіру:
Згорає на повітрі і в кисні з виділенням тепла:
Взаємодіє з гідридами і гидроксидами лужних металів з утворенням етілат:
Вступає в реакцію гідрогалогенірованіе в присутності хлориду цинку:
Етанол може використовуватися як паливо, в т. Ч. Для ракетних двигунів (так, етанол використовувався в якості палива в першій в світі серійної балістичної ракети - німецької «Фау-2»), двигунів внутрішнього згоряння в чистому вигляді. Обмежено в силу своєї гігроскопічності (відшаровується) використовується в суміші з класичними нафтовими рідкими паливами. Застосовується для вироблення високоякісного палива і компонента бензинів - етил-трет-бутилового ефіру, більш незалежного від викопної органіки, ніж МТБЕ.
§ служить сировиною для отримання багатьох хімічних речовин, таких, як ацетальдегід, діетиловий ефір, тетраетилсвинець, оцтова кислота, хлороформ, етилацетат, етилен і ін .;
§ широко застосовується як розчинник (в лакофарбової промисловості, у виробництві товарів побутової хімії та багатьох інших областях);
§ є компонентом антифризів і стеклоомивателей;
§ у побутовій хімії етанол застосовується в чистячих і миючих засобах, особливо для догляду за склом і сантехнікою. Є розчинником для репелентів.
§ за своєю дією етиловий спирт можна віднести до антисептиків;
§ як знезаражувальне і підсушує засіб, зовнішньо;
§ підсушують і дубящие властивості 96% -го етилового спирту використовуються для обробки операційного поля або в деяких методиках обробки рук хірурга;
§ розчинник для лікарських засобів, для приготування настоянок, екстрактів з рослинної сировини та ін .;
§ консервант настоянок і екстрактів (мінімальна концентрація 18%);
§ піногасник при подачі кисню, штучної вентиляції легенів;
§ в зігріваючих компреси;
§ для фізичного охолодження при лихоманці (для розтирання) [3];
§ компонент загальної анестезії в ситуації дефіциту медикаментозних засобів;
§ як піногасник при набряку легенів у вигляді інгаляції 33% розчину;
§ етанол є протиотрутою при отруєнні деякими токсичними спиртами, такими як метанол і етиленгліколь. Його дія обумовлена тим, що ферменталкогольдегідрогеназа, при наявності декількох субстратів (наприклад, метанол і етанол) здійснює лише конкурентну окислення, завдяки чому після своєчасного (майже негайного, слідом за метанолом / етиленгліколь) прийому етанолу зменшується поточна концентрація токсичних метаболітів (для метанолу - формальдегіду і мурашиної кислоти, для етиленгліколю - щавлевої кислоти) [4].
Парфумерія і косметика
Є універсальним розчинником різних речовин і основним компонентом духів, одеколонів, аерозолів і т. П. Входить до складу різноманітних засобів, включаючи навіть такі як зубні пасти, шампуні, засоби для душа, і т. Д.
Розчинник для харчових ароматизаторів. Може бути використаний як консервант для хлібобулочних виробів, а також в кондитерській промисловості. [6]
З нами в якості харчової добавки E1510 [7].
Енергетична цінність етанолу - 7,1 ккал / г.
Формальдегід (від лат. Form # 299; ca «мураха») - безбарвний газ з різким запахом, добре розчинний у воді, спиртах та полярних розчинниках. Ирритант, токсичний.
Формальдегід - перший член гомологічного ряду аліфатичних альдегідів, альдегід мурашиної кислоти.
Через низьку електронної щільності на атомі вуглецю формальдегід легко вступає в реакції навіть зі слабкими нуклеофилами. Цим, зокрема, пояснюється той факт, що у водних розчинах формальдегід знаходиться в гидратированной формі.
Формальдегід вступає в усі реакції, характерні для аліфатичних альдегідів. Зокрема, в реакції з нуклеофилами і відновними реагентами.
Основний промисловий метод отримання формальдегіду - окислення метанолу:
Окислення метанолу в формальдегід проводиться з використанням срібного каталізатора при температурі 650 ° C і атмосферному тиску. Це добре освоєний технологічний процес, і 80% формальдегіду виходить саме за цим методом. Нещодавно розроблений більш перспективний спосіб, заснований на використанні залізо-молібденових каталізаторів. При цьому реакція проводиться при 300 ° C. В обох процесах ступінь перетворення становить 99% [1].
Процес дегідрірованія метанолу, здійснений на цинк-мідних каталізаторах при 600 ° C, поки не набув широкого розвитку, проте він є дуже перспективним, оскільки дозволяє отримувати формальдегід, який не містить води.
Існує також промисловий спосіб отримання формальдегіду окисленням метану:
Процес проводять при температурі 450 ° C і тиску 1-2 МПа, як каталізатор застосовується фосфат алюмінію AlPO4.
Безпека та токсичні властивості
Формальдегід утворюється в організмі шляхом окислення метанолу.
Володіє токсичністю, негативно впливає на генетичний матеріал, репродуктивні органи, дихальні шляхи, очі, шкірний покрив. Надає сильну дію на центральну нервову систему.
Гранично допустимі концентрації (ГДК) формальдегіду: [2] [3] [4]
§ ПДКр.з. = 0,5 мг / м³
§ ПДКм.р. = 0,035 мг / м³
§ ПДКс.с. = 0,003 мг / м³
Смертельна доза 35% водного розчину формальдегіду (формаліну) становить 10-50 м
Водний розчин формальдегіду - формалін - викликає денатурацію білків, тому він застосовується в якості дубителя в шкіряному виробництві та дублення желатину при проізводствекінофотоплёнкі. Через сильний дубящего ефекту формальдегід також є і сильним антисептиком, це властивість формаліну використовується в медицині, як антисептик (формідрон, Формагель і подібні препарати) і для консервації біологічних матеріалів (створення анатомічних та інших препаратів).
Основна частина формальдегіду йде на виготовлення полімерів-реактопластів (фенолформальдегідні, карбамідформальденідние і меламінформальдегідні смоли), він також широко використовується в промисловому органічному синтезі (пентаеритрит, триметилолпропан і т.д.).
Формальдегід добре розчин. в воді, спиртах та ін. полярних р-телеглядачам. При низьких т-рах змішується в будь-яких співвідношеннях з неполярними р-телеглядачам: толуолом, діетиловим ефіром, етилацетат, CHCl3 (зі збільшенням т-ри р-рімость падає), не розчин. в петролейном ефірі. Водні розчини формальдегіду містять рівноважну суміш моногідрату CH2 (OH) 2 (99,9%), нестійкого в своб. стані, і полімергідратов HO (CH2 O) n H (п = 2-8), стійких кристалічних. з'єднань. При продовжить. зберіганні водних розчинів (особливо при низьких т-рах) і при їх концентруванні ступінь полімерізацііувелічівается. Для зберігання водних розчинів формальдегіду їх стабілізують метанолом (див. Формалін). При упарюванні водних розчинів в вакуумі образуетсяпараформ, або параформальде-гід (CH2 O) n (n = 8-12), при дії лугу на конц. водні розчини - т. зв. a-полиоксиметилен (n> 100). Полімеризація в неполярному р-телеглядачам призводить до Поліформальдегід (n> 1000).
Параформ - бесцв. кристали з запахом формальдегіду, т. пл. 120-170 0 C, в холодній воді р-ряется повільно, в гарячій -Швидко, утворюючи розчини формальдегіду, погано розчин. в ацетоні; горючий, т. доп. 72 0 C.
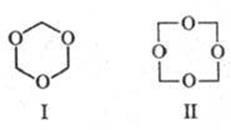
Відомі циклич. полімери формальдегіду: триоксану (ф-ла I, т. пл. 64 0 C), одержуваний перегонкою 60% -ного водного розчину формальдегіду з разб. H2 SO4. і тетраоксіметілен (ф-ла II, т. пл. 112 0 C), що утворюється при нагр. діацетату високомол. поліоксиметілена.
Формальдегід володіє високою реакційною здатністю. Відновлюється H2 у присутності. багатьох металів або їх оксидів (напр. Ni, Pt, Cu) до метанолу; окислюється HNO3. KMnO4 до мурашиної к-ти або CO2 і H2 O; тримає в облозі мн. метали (Ag, Pt, Au, Bi і ін.) з розчинів їх солей, окислюючись при цьому в мурашину к-ту.
З альдегидами у присутності. сильних лугів формальдегід вступає в т. зв. перехресну р-цію Канниццаро (C6 H5 CHO + HCHO C6 H5 CH2 OH + HCOONa); з ацетальдегідом у присутності. Ca (OH) 2 утворює пентаеритрит, в паровій фазі при 285 0 C - акролеїн; під дією алкоголятов Al або Mg формальдегід піддається диспропорціонування з утворенням ме-тілфоміата (див. Тищенко реакція).
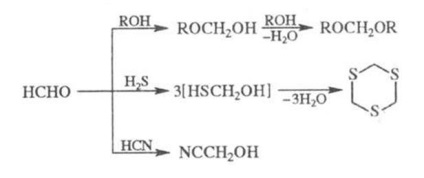
Р-ція формальдегіду зі спиртами у присутності. сильних к-т призводить до ацеталів (формальний), з H2 S - до циклич. трітіану, з HCN у присутності. лугів - кціангідріну:
Формальдегід приєднується до олефінам у присутності. кислих каталізаторів з утворенням 1,3-дігліколей і 1,3-діоксанів (див. Прінса реакція), р-ція формальдегіду з ізобутіленом дає изопрен, Рідкофазний конденсація з пропиленом у присутності. BF3 або H2 SO4 - бутадієн. З формальдегіду і кетена в пром-сті отримують b-пропіолактон.
Р-ція формальдегіду з ацетиленом - пром. спосіб отримання бутадієну (див. Рeппe реакції), при взаємодій. двох молекул формальдегіду з ацетіленомобразуется 2-бутин-1,4-діол.
В присутності. вапна формальдегід перетворюється в вуглеводи:
При взаємодій. формальдегіду з NH3 утворюється гексаметилентетрамін, з первинними амінами - тримери, з вторинними - біс (ді-алкіламіно) метану:
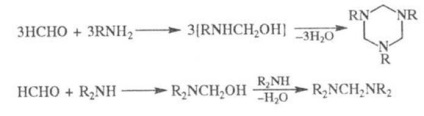
Соед. з рухомим атомом водню реагують з формальдегідом та NH3 (або амінами) по манних реакції. Р-ція формальдегіду з NH4 Cl пром. спосіб отримання метиламіни: 2НСНО + NH4 Cl CH3 NH2 · HCl + HCOOH (р-ція може йти далі з утворенням ді- і триметиламіну). З сечовиною в лужному середовищі формальдегід дає моно- і діметілольние похідні, поликонденсацией яких брало отримують мочевино-формальдегідні смоли, а ізмеламіна і формальдегіда- меламіно-формальдегідні смоли.
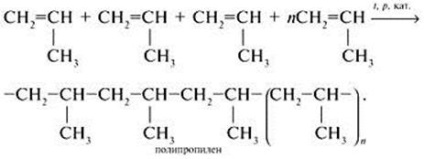
Пропілен (пропен) СН2 = СН-СН3 - неграничні (ненасичений) вуглеводень ряду етилену, горючий газ. Наркотик з наркотичною дією сильнішим, ніж у етилену. Клас небезпеки - четвертий. [1].
Пропілен є газоподібна речовина з низькою температурою кипіння tкип = -47,7 ° C і температурою плавлення tпл = -187,6 ° C, оптична щільність d20 4 = 0,5193.
Має значну реакційною здатністю. Його хімічні властивості визначаються подвійний вуглець-вуглецевим зв'язком. p-зв'язок, як найменш міцна і доступніша, при дії реагенту розривається, а вивільнені валентності вуглецевих атомів витрачаються на приєднання атомів, з яких складається молекула реагенту. Всі реакції приєднання протікають по подвійному зв'язку і складаються в розщепленні π-зв'язку алкена і освіті на місці розриву двох нових # 963; -зв'язків.
Найчастіше реакції приєднання йдуть по гетеролітичні типу, будучи реакціями електрофільного приєднання.
Приєднання галогенів (галогенирование)
Реакцію галогенування зазвичай проводять в розчиннику при звичайній температурі. Галогени легко приєднуються за місцем розриву подвійного зв'язку з утворенням дігалогенопроізводних. Легше йде приєднання хлору і брому, важче - йоду. Фтор взаємодіє з вибухом.
] Приєднання водню (реакція гідрування)
Приєднуючи водень в присутності каталізаторів (Pt, Pd, Ni), пропен переходить в граничний вуглеводень - пропан.
Приєднання води (реакція гідратації)
Пропілен реагує з водою з утворенням одноатомного спирту изопропанола, при цьому подвійний зв'язок розкривається.
Приєднання галогеноводородов (HHal)
Відбувається за правилом Марковникова. Водень кислоти HHal приєднується до найбільш Гідрований атому вуглецю при подвійному зв'язку. Відповідно залишок Hal зв'язується з атомом вуглецю, при якому знаходиться менше число атомів водню.

Приклад гідрогалогенірованіе - отримання бромпохідні пропану при реакції бромоводорода і пропилену.
Див. Також: гідрогалогенірованіе алкенов
Горіння на повітрі
При підпалюванні горить на повітрі: 2СН2 = СНСН3 + 9О2 → 6СО2 + 6Н2 О.
З киснем повітря газоподібний пропилен утворює вибухові суміші.
У слабощелочной або нейтральної водному середовищі пропілен окислюється перманганатом калію, що супроводжується знебарвлення розчину KMnO4 і освітою гликолей (з'єднань з двома гідроксильних груп при сусідніх атомах вуглецю). Ця реакція отримала назву реакції Вагнера.
Умови реакції: нагрівання, присутність каталізаторів. З'єднання молекул відбувається шляхом розщеплення внутрішньомолекулярних π-зв'язок і утворення нових міжмолекулярних # 963; -cвязей.