1. Загальна характеристика процесів галогенування 4
2. Техніка безпеки в процесах галогенування 9
3. Хімія і технологія процесу 10
Список літератури 12
Виробництво органічних речовин зародилося дуже давно, але спочатку воно базувалося на переробці рослинної або тваринної сировини - виділення цінних речовин (цукор, масла) або їх розщеплення (мило, спирт і ін.). Органічний синтез, т. Е. Отримання більш складних речовин із порівняно простих, зародився в середині XIX століття на основі побічних продуктів коксування кам'яного вугілля, що містили ароматичні сполуки. Потім, уже в XX столітті як джерела органічної сировини все більшу роль стали грати нафта і природний газ, видобуток, транспорт і переробка яких більш економічні, ніж для кам'яного вугілля. На цих трьох видах викопного сировини головним чином і базується промисловість органічного синтезу. У процесах їх фізичного поділу, термічного або каталітичного розщеплення (коксування, крекінг, піроліз, риформінг, конверсія) отримують п'ять груп вихідних речовин для синтезу багатьох тисяч інших з'єднань:
1. Парафін (від метану СН4 до вуглеводнів С15 - С40);
2. Олефіни (С2Н4, С3Н6, С4Н8, С5Н10);
3. Ароматичні вуглеводні (бензол, толуол, ксилоли, нафталін);
5. Оксид вуглецю і синтез-газ (суміш СО і Н2).
У своєму розвитку промисловість органічного синтезу розділилася на ряд галузей (технологія барвників, лікарських речовин, пластичних мас, хімічних волокон і ін.), Серед яких важливе місце займає промисловість основного органічного і нафтохімічного синтезу. Термін «основний» (або «важкий») органічний синтез охоплює виробництво многотонажних продуктів, які є основою для всієї іншої органічної технології. У свою чергу, термін «нафтохімічний» синтез з'явився в зв'язку з перетворенням технології органічних речовин на нафтову сировину і в звичайному сенсі слова (виключаючи отримання неорганічних речовин і полімерів) охоплює первинну хімічну переробку вуглеводнів нафтового походження. У цьому плані він є частиною основного органічного синтезу, що навіть зумовлено їх об'єднане початок.
1. Загальна характеристика процесів галогенування
1. галогенопохідних отримують трьома основними шляхами: за-розміщенням, приєднанням і розщепленням.
Замісне (субстітутівное) галогенирование полягає в заміщенні на атоми галогену інших атомів або груп. З них найбільше значення має заміщення атомів водню
RH + CI 2 → RCI + HCI
яке може відбуватися при насичених і ненасичених атомах вуглецю або в ароматичному ядрі. Здатність до заме-щенію зберігається у різних похідних вуглеводнів.
Заміщення одного атома галогену на інший має значення для отримання фтор, бром - і йодопохідні з більш доступних хлорорганічних сполук:
CCI4 + 2HF → CCI2F2 + 2HCI
RCI + NaBr → RBr + NaCI
Заміщення ОН - групи на галоген застосовують для отримання деяких галогенопроізводних, а також хлорангидридов кислот:
ROH + HCI → RCI + H2O
RCOOH + COCI2 → RCOCI + CO2 + HCI
Приєднувальний (адитивна) галогенирование - приєднання галогеніруются агентів до ненасичених сполук має настільки ж велике практичне значення, як заміщення. Вільні галогени здатні приєднуватися зі зв'язків С = С, С≡С і Сар-Сар:
CH2 = CH2 + CI2 → CICH2-CH2CI
CH≡CH + 2CI2 → CHCI2-CHCI2
C 6 H 6 + 3 CI 2 → C 6 H 6 CI 6
Галогеноводороди приєднуються за подвійною і потрійною зв'язків (гідрогалогенірованіе), а олефіни вступають також в реакцію хлоргідрірованія:
CH2 = CH2 + HCI → CH3-CH2CI
CH≡CH + HCI → CH2 = CHCI
CH2 = CH2 + CI2 + H2O → CH2CI-CH2OH + HCI
Здатність до перерахованих реакцій адитивного галогенування зберігається у багатьох похідних ненасичених вуглеводнів.
Особливий випадок адитивного хлорування представляє приєднання хлору по атомам, що знаходяться в нижчому валентних станів, наприклад синтез фосгену з оксиду вуглецю і хлору:
CO + CI 2 → COCI 2
Реакції розщеплення хлорпроізводних набувають все більш важливе значення. З них найбільш легко відбувається дегідрохлорування (1), зворотне приєднання HCI. Через перевагу протікання цієї реакції інші процеси розщеплення спостерігаються тільки при високій температурі у перхлорпроізводних. Це - діхлорірованіе (2), зворотне приєднання CI 2. і розщеплення по вуглець-вуглецевим зв'язків, яке може відбуватися під дією хлору - хлороліз (3), або хлоріноліз, або при підвищеній температурі - піроліз (4):
CH2CI-CH2CI CH2 = CHCI + HCI
CCI3-CCI3 CCI2 = CCI2 + CI2
CCI3-CCI3 + CI2 2CCI4
CCI3-CCI2-CCI3 CCI4 + CCI2 = CCI2
2. Термодинаміка реакцій галогенування
Реакції галогенування сильно розрізняються енергетичними характеристиками, що зумовлює їх суттєві особливості. Нижче зіставлені теплові ефекти реакцій за участю фтору, хлору, брому та йоду для ідеального газоподібного стану речовин:
Як видно з наведених даних, парниковий ефект зменшується в ряду F 2> CI 2> Br 2> I 2. причому особливе місце займають реакції фторування і йодування. Перші супроводжуються дуже великим виділенням тепла, що перевищує енергію розриву зв'язків С-С і С-Н. Якщо не вжити особливих заходів, це призведе до глибокої розкладання органічної речовини. З іншого боку, йодування протікає дуже невеликим або навіть негативним тепловим ефектом і, на відміну від реакцій з фтором, хлором і бромом, є оборотним. Це поряд з низькою активністю йоду як реагенту змушує отримувати йодопохідні іншими шляхами. Втім, вони виробляються в малих масштабах і не належать до продуктів основного органічного і нафтохімічного синтезу.
Теплові ефекти деяких реакцій за участю галогеноводородов при ідеальному газоподібному стані речовин такі:
C 2 H 4 + HF → C 2 H 5 F ()
C 2 H 4 + HCI → C 2 H 5 CI ()
C2H4 + HBr → C2H5Br ()
C2H4 + HI → C2H5I ()
C 2 H 5 OH C 2 H 5 CI ()
Всі ці реакції екзотермічни, причому для галогеноводородов відмінність менше, ніж для вільних галогенів. Важливо, що всі реакції за участю галогеноводородов оборотні.
3. галогеніруются агенти
Найбільше значення в якості галогеніруются агентів мають вільні галогени і безводні галогеноводороди. Їх температури кипіння при атмосферному тиску наведені в таблиці 1.
Температура кипіння галогенів і галогеноводородов при атмосферному тиску
Всі вони розчиняються в органічних рідинах (Br 2> CI 2> F 2 і HBr> HCI> HF), що вельми важливо для проведення жидкофазная процесів галогенування. Мають різкий запах, подразнюють слизові оболонки очей і дихальних шляхів, а вільні галогени мають, крім того, задушливим дією. Особливо небезпечні фтор і фторид водню, здатні роз'їдати шкірні покриви і кісткову тканину.
Хлор отримують електролізом водних розчинів NaCI (розсоли), коли одночасно утворюються водень і електролітична луг:
Na + + HO- → NaOH
Одержуваний при цьому хлор-газ має концентрацію ≈ 92% CI 2 і містить домішки N 2. O 2 і CO. Їх можна відокремити шляхом зрідження хлору, випаровування якого дає чистий продукт, часто більш кращий для процесів хлорування.
Хлорид водню отримують високотемпературним синтезом з водню і хлору:
H 2 + CI 2 → 2 HCI
Фтор виробляють електролізом розплаву гідродіфторіда калію KHF 2. а безводний фторид водню - дією сірчаної кислоти на плавиковий шпат:
CaF2 + H2SO4 → CaSO4 + 2HF
Все галогеніруются агенти агресивні по відношенню до матеріалу апаратури, причому їх корродіруют дію особливо зростає в присутності навіть слідів вологи. Тому в процесах фторування для виготовлення апаратури застосовують мідь або нікель, а під час хлорування і бромуванні захищають сталевий корпус емалями, свинцем або керамічними матеріалами, використовують також спеціальні сорти сталей, графіт, сікло і для виготовлення труб - свинець. Для зниження корозії як галогеніруются, так і органічні реагенти потрібно піддавати осушення.
2. Техніка безпеки в процесах галогенування
Крім загальних питань, пов'язаних з токсичністю і вибухонебезпечність вихідних речовин (вуглеводні, оксид вуглецю), при Галогенування виникає і ряд специфічних умов техніки безпеки.
Не тільки галогеніруются агенти, але і одержувані галогенпохідних часто володіють підвищеною токсичністю. Вони впливають на центральну нервову систему, справляють гнітюче або наркотичну дію (хлороформ, хлораль), подразнюють слизові оболонки очей і дихальних шляхів (бензілхлорід, хлорацетон), а фосген надає задушливе дію. Внаслідок цього при Галогенування пред'являються підвищені вимоги до герметичності обладнання та вентиляції цехів. На робочих місцях необхідні кошти надання першої допомоги і протигази.
Вільні галогени подібно кисню і повітрю можуть давати з вуглеводнями і оксидом вуглецю вибухонебезпечні суміші. Процес їх горіння в атмосфері галогенів дуже екзотермічен і при певних концентраціях переходить у вибух. Нижній і верхній межі вибуховості для сумішей нижчих парафінів і олефінів з хлором лежать в інтервалі від 5 до 60% (об.) Вуглеводню. Це зумовлює необхідність вжиття спеціальних заходів безпеки при змішуванні вуглеводнів з галогенами, особливо при високотемпературних газових реакціях. Але вибухонебезпечність цих виробництв ще більш посилюється тим, що багато галогенопроїзводниє дають вибухонебезпечні суміші з повітрям. Так, межі вибуховості в сумішах з повітрям складають (об.):
CH 3 CI - 7,6 ÷ 19,0
C 2 H 5 CI - 3,8 ÷ 15,4
C 2 H 4 CI 2 - 6,2 ÷ 16,0
При збільшенні числа атомів галогену в молекулі вибухонебезпечність з'єднання знижується, а тетрахлорид метану навіть застосовують для гасіння пожеж.
3. Хімія і технологія процесу
Оксіхлорірованіе і відщеплення HCI проводиться в різних реакторах. Але при підвищенні температури до 400 - 4500С з'являється можливість поєднати обидва процеси і з надлишком компенсувати витрати тепла на розщеплення. На цьому заснований один з найефективніших в даний час методів отримання три - і тетрахлоретилену - з 1,2-дихлоретану або інших хлорпроізводних C 2.
2CH2CI-CH2CI + CI2 + 1,5O2 → 2CHCI = CCI2 + 3H2O
2CH2CI-CH2CI + 2CI2 + 2O2 → 2CCI2 = CCI2 + 4H2O
У порівнянні з поєднаним хлоруванням і дегідрохлорування 1,2-дихлоретан він вигідно відрізняється мінімальною витратою хлору і відсутністю побічного освіти HCI. Очевидно, що в цьому процесі в залежності від співвідношення хлору і 1,2-дихлоретан виходить суміш хлоретіленов, причому недостатньо прохлорірованние речовини повертають на реакцію. Процес можна направити і на спільне отримання три - і тетрахлоретіленов, використовуючи в якості сировини не тільки 1,2-дихлоретан, але і різні відходи хлорпроізводних C 2. Процес здійснюють в реакторі з псевдозрідженим каталізатором, знімаючи зайве тепло киплячим водним конденсатом і генеруючи пар високого тиску. У промисловості є установки великої потужності для спільного отримання три - і тетрахлоретіленов даним методом. При використанні тетрахлоретана взагалі відпадає потреба в сторонньому хлоре:
CHCI2-CHCI2 + 0,5O2 → CCI2 = CCI2 + H2O
З метою ще більшого здешевлення хлорпроізводних C 2 в якості сировини застосовують етан або його суміші з етиленом. Так, представляв інтерес процес «Транскат», в якому реакції проводилися в циркулюючому розплаві каталізатора оксіхлорірованія з поділом стадій хлорування і окислення. Він не отримав розвитку через громіздкої системи циркуляції великих мас розплаву. Інші методи засновані на комбінуванні або поєднанні прямого і окисного хлорування з відщепленням HCI і з іншими реакціями. Так, в одному з реалізованих в промисловості процесів (рис. 1) в реакторі 1 суміщені пряме хлорування етану (або його сумішей з етиленом) і відщеплення HCI від хлорпроізводних. На установці 2 з продуктів першої стадії виділяють цільові хлоролефіни (вінілхлорид, вінілденхлорід), а інші речовини, включаючи етилен, непревращенний етан і HCI. направляють в реактор 3 на оксіхлорірованіе. Тут отримують хлоретану, які відокремлюють від повітря і повертають в реактор 1. Процес комбінують з гідрохлорування винилиденхлорида для виробництва метилхлороформ і з окислювальним хлоруванням всіх нецільових хлорорганічних речовин в три - і тетрахлоретилен.
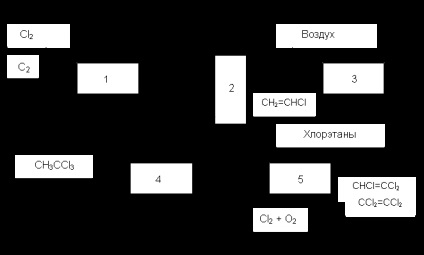

Мал. 1 Блок-схема комбінованої переробки етану або його сумішей з етиленом
1. Термічне хлорування і дегідрохлорування, 2. Ректификация, 3. Окислительное хлорування, 4. гідрохлорування, 5. Окислительное хлорування і дегідрохлорування
Таким чином, поява промислових процесів, суміщених і комбінованих з розщепленням хлорпроізводних і окислювальним хлоруванням, має великий вплив на технологію синтезу найбільш многотонажних хлорорганічних продуктів, на економічну ефективність цих виробництв і охорону навколишнього середовища. Ведеться посилена розробка і впровадження цих процесів, які поступово витісняють застарілі і менш ефективні виробництва.
2. Чичибабін початку органічної хімії. М. Госхіміздат, 1963. - 922 с .;
3. Лебедєв і технологія основного органічного і нафтохімічного синтезу. М. Хімія. 1988. - 592 с .;
4. Вишнякова нафтохімічного синтезу. М. 1973. - 448 с .;
5. Юкельсон основного органічного синтезу. М. «Хімія», 1968.