Існує безліч визначень поняття "апоптоз":
- явище програмованої клітинної смерті, що супроводжується набором характерних цитологічних ознак (маркерів апоптозу) і молекулярних процесів, що мають відмінності в одноклітинних і багатоклітинних організмів (тобто змін у будові і функціонуванні клітини, характерних для апоптозу).
- форма загибелі клітини, що виявляється в зменшенні її розміру, конденсації (ущільненні) і фрагментації хроматину, ущільненні зовнішньої і цитоплазматичної мембран без виходу вмісту клітини в навколишнє середовище.
Суть апоптозу полягає в тому, що це програмована клітинна загибель, тобто існують певні механізми, в результаті реалізації яких клітина сама завершує своє існування.
У багатоклітинних організмі апоптоз му гинуть клітини в процесі ембріогенезу, Т-клітини в процесі диференціювання в тимусі, клітини, заражені вірусами, змінені клітини (при недостатній інтенсивності апоптотичних процесів розвиваються онкологічні захворювання) і мн. др.Основное біологічне призначення апоптоз а полягає в тому, щоб в процесі ембріонального морфонегеза створювати органи і тканини з еволюційно закріпленими конфігураціями і розмірами і потім підтримувати ці параметри з допустимими допусками протягом життя.
Найважливішим проявом цієї функції апоптоз а після закінчення розвитку людини та інших ссавців є його участь в процесі фізіологічної регенерації (відновлення) клітин різних тканин і органів і підтримці клітинного гомеостазу. Регенерації в різного ступеня вираженості протягом усього життя схильні практично всі клітини нашого організму. Особливо інтенсивно клітинне оновлення протікає в клітинах епітелію, які стикаються із зовнішнім середовищем, шкіри, шлунково-кишкового тракту, сечостатевої та легеневої систем, а також в клітинах крові, імунної системи.
Важлива роль і в процесах відторгнення чужорідних органів і тканин при їх трансплантації.
Іншою найважливішою функцією апоптоз а є контроль за внутрішнім середовищем клітини, в тому числі клітинного ядра з його вмістом. Правда, зараз показано, що апоптоз може протікати і в клітинах, позбавлених ядра. При виникненні в клітці порушень, що перевищують допустимі межі, клітина піддається самознищення. Апоптоз виникає при дії різних факторів, які здатні викликати некроз, але діють в невеликих дозах, наприклад, при дії високої температури, іонізуючого випромінювання, протипухлинних препаратів.
Апоптоз бере активну участь в ряді фізіологічних і патологічних процесів. Наприклад, при гормон-залежною інволюції органів у дорослих, зокрема, відторгнення ендометрію під час менструального циклу, атрезії (заращении) фолікулів в яєчниках в менопаузі і регресії (зворотному розвитку) молочної залози після припинення лактації.
Велика роль апоптоз а й при патологічної атрофії гормон-залежних органів, наприклад, атрофії передміхурової залози після кастрації і виснаженні лімфоцитів в тимусі при терапії глюкокортикоїдами. Або патологічної атрофії паренхіматозних органів після обтурації (закупорки) вивідних проток, що спостерігається в підшлунковій і слинних залозах, нирках. Загибель клітин в процесі атрофії спостерігається і в корі надниркових залоз при впливі глюкокортикоїдів або при атрофії ендокринної-залежних тканин.
У багатьох випадках гострого або хронічного ішемічного або токсичного впливу загибель клітин відбувається через апоптоз. Така картина спостерігається при інсульті, інфаркті не тільки міокарда, але і в нирках, при діабеті, окремих формах нефриту, нейродегенеративних захворюваннях, таких як хвороба Альцгеймера і Паркінсона. У патогенезі токсичних пошкоджень печінки, підшлункової залози і нирок активація апоптоз а також має важливе значення.
Форми клітинної загибелі, їх відмінності
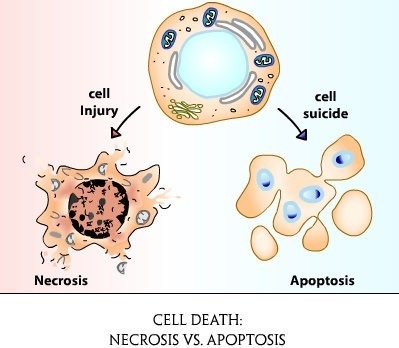
Існує дві форми загибелі клітини - некроз і апоптоз.
Некроз - це патологічний процес, що виражається в місцевій загибелі тканини в живому організмі в результаті якого-небудь екзо- (зовнішнього) або ендогенного (внутрішнього) її пошкодження. Некроз проявляється в набуханні, денатурації та коагуляції (злипанні) цитоплазматических білків, руйнуванні клітинних органел і, нарешті, всієї клітини.
Головна відмінність некрозу і апоптоз а полягає в тому, що апоптоз - це програмована загибель клітини, а некроз - це патологічний процес, що запускається у відповідь на будь-яке шкідливу дію (інфекція, хімічний вплив, опромінення, недостатнє кровопостачання і т.д.) .
В процесі апоптоз а в клітці задіяні складні молекулярні каскади, в результаті реалізації яких відбувається зморщування цитоплазматичної мембрани, зменшення обсягу клітини, розриви ниток ядерної ДНК, конденсація хроматину по периферії ядра, подальший розпад ядра на частини, фрагментація клітин на везикули (пухирці) з внутрішньоклітинним вмістом - апоптотичні тільця, які захоплюються сусідніми клітинами, можуть і фагоцитами, як у випадку некрозу. Викиду клітинного вмісту не відбувається, запалення не виникає.
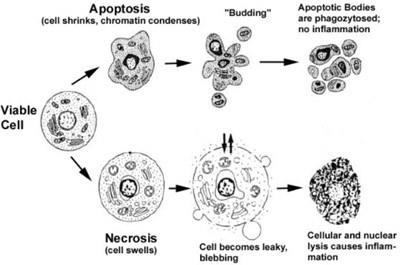
При некрозі, навпаки, відбувається вихід лізосомальних ферментів з лізосом, які і переварюють уміст клітки, клітка набухає і лопається. Вміст клітини викидається в позаклітинне середовище, де поглинається фагоцитами, розвивається запалення.
Апоптоз- це фізіологічний процес, некроз- патологічний.
Існують і інші форми програмованої загибелі, наприклад, аутофагія. Процес аутофагії полягає в тому, що органели з'єднуються з лізосомами, де перетравлюються лізосомальними ферментами. Потім залишки клітини поглинають макрофаги.
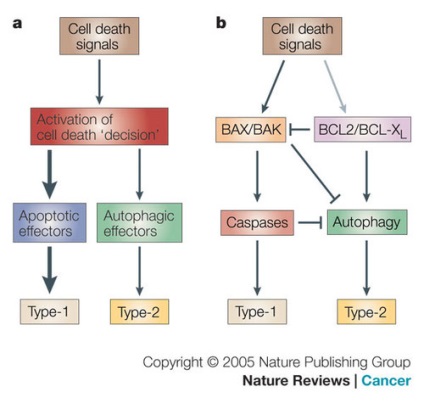
а) - Кінетична модель балансу апоптоз а й аутофагії. Одне з летальних впливів активує в клітці програму і клітина "вирішує померти". Якщо досить апоптотических ефекторів (молекул, задіяних в процесі апоптоз а), то апоптоз є єдиною відповіддю більшості клітин на летальну дію. Придушення апоптотических ефекторів запускає альтернативний шлях-Аутофагія.
b) - Інгібіторна модель. Коли летальну дію активує BAX / BAK- залежний мітохондріальний внемембранний шлях (BAX / BAK-dependent mitochondrial outer-membrane permeabilization pathway) запускається апоптоз. BAX / BAK, так само як і каспаз, є активним інгібітором BCL2 / BCL-XL, що полегшує Аутофагія. Активний апоптоз пригнічує Аутофагія.
3D модель апоптозу
механізми апоптозу
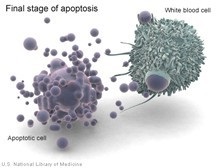
Механізми апоптоз а складні і різноманітні, представляють собою складний молекулярний каскад, вивченням якого займаються багато і багато лабораторій по всьому світу. Безперечна важливість цих досліджень в аспекті онкології і геронтології доведена успіхами терапії онкологічних захворювань індукторами апоптоз а ракових клітин. Так які ж механізми. Поговоримо про це по-докладніше.
Перший етап - смертельний наказ
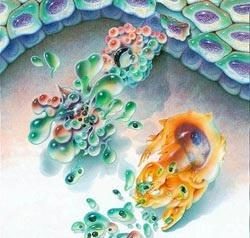
З чого ж починається цей складний процес? З того, що клітина отримує "наказ померти", її загибель необхідна для подальшої життєдіяльності організму. Це відбувається за допомогою сигналів з позаклітинного середовища, які клітина сприймає за допомогою свого рецепторного апарату. Іноді сигналом для початку апоптоз а може бути і відсутність необхідного сигналу.
В результаті контакту сигнальних молекул з зовнішньою частиною білка-рецептора цей рецептор зазнає структурні зміни. Структурна перебудова захоплює і внутрішньоклітинну частину молекули рецептора. Вона може або мати певну ферментативної активністю сама, або бути тісно пов'язана з деякими клітинними ферментами. Зміна активності рецепторной молекули призводить до активації ферменту.
Часто мова йде про зміну концентрації іонів кальцію. а також деяких щодо дрібних фосфоровмісних органічних сполук, що відносяться до класу нуклеотидів.
Активні сполуки з'являються і в результаті гідролізу певних ліпідів клітинної мембрани. У свою чергу, все це веде до приєднання або від'єднання залишків фосфату від молекул білкових регуляторів (фосфорилювання), здатних впливати на генетичний апарат клітини.
Фосфорилювання і дефосфорілірованіе (відщеплення залишку фосфорної кислоти), а також деякі інші біохімічні модифікації змінюють активність цих регуляторів.
Рецептори, що сприймають "летальний сигнал"
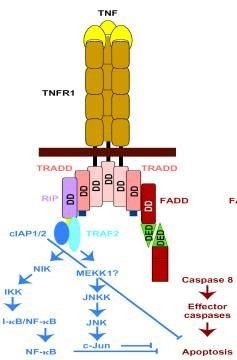
Відомі два структурно гомологічних рецептораTNF. р55 і р75 (TNF-RI і TNF-RII. відповідно), що відносяться до трансмембраним білкам I типу. Крім цього задіяні "рецептори смерті" CD95. Рецептори CD95 і рецептори TNF належать до зростаючого суперсімейство рецепторів, що мають гомологію в екстраклеточной доменах. Сімейство включає в себе також рецептор фактора росту нервів. В-клітинний антиген CD40. маркер активації Т-лімфоцитів CD27 і деякі гомологічні білки ссавців і вірусів.
CD95 і TNF-R1 мають додаткову гомологичную послідовність у внутрішньоклітинної частини молекул. Цей трансдукції цитотоксического (пошкоджуючого клітку) сигналу. Цитоплазматичний С-кінець CD95 містить також "домен порятунку". видалення якого підсилює цитотоксичну активність рецептора.
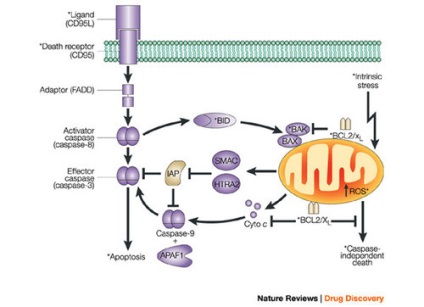
TNF і ліганд CD95 (CD95-L) є трансмембранними білками другого типу з позаклітинним С-кінцевим, внутрішньоклітинним N-кінцевим і одним трансмембраним елементами, але вони можуть функціонувати і в розчинній, "слущенного" з мембрани формі. І CD95-L, і TNF зв'язуються з відповідним рецепторами у вигляді тримера, "зшивають" 3 молекули рецептора, що активує його для передачі проапоптотического сигналу.
Інтенсивні дослідження сигнальних механізмів апоптоз а, індукованого антитілами до CD95 / CD95-L і TNF, привели до значного прогресу в двох напрямках - ідентифікація білків, що взаємодіють з CD95 і TNF-R1, і з'ясування участі в процесі вторинного месенджера цераміду.
"Домен смерті" TNF-R1 взаємодіє також з серин / треонінових протеїнкіназою і фосфорилируется цим ферментом. 30 С-кінцевих амінокислотних залишків інгібують зв'язування рецептора з протеїнкіназою. Роль цих подій в передачі цитотоксического сигналу неясна. Нещодавно описана тирозинового фосфатаза. FAP-1. взаємодіє з 15 С-кінцевими амінокислотами CD95, "доменом порятунку". Гіперекспресія FAP-1 пригнічує апоптоз. опосередкований CD95.
Описані білки беруть участь, по-видимому, в початкових етапах передачі сигналу. Інша група даних свідчить про те, що і CD95-L або антитіла до CD95, і TNF активують сфінгоміеліновий шлях передачі.
Пізні етапи клітинної загибелі, індукованої через CD95 і TNF-R1, такі ж, як при класичному апоптоз е. Загибель клітин може бути відвернена crmA. що вказує на участь ICE-подібних протеаз. Bcl-2 пригнічує апоптоз. індукований через CD95 і TNF-R1, принаймні на деяких клітинних лініях.
Участь FAS (CD95)
Цей шлях передачі летального сигналу схематично можна зобразити таким чином: індуктори - рецептори - адаптери -каспази першого ешелону -Регулятор -каспази другого ешелону. Так, рецептор, що позначається Fas, взаємодіючи з відповідним лігандом (лігандом FasL), трансмембраним білком Т-кілера, активується і запускає програму смерті клітини, інфікованої вірусом. Тим же шляхом при взаємодії з лігандом FasL на поверхні Тh1-лімфоцитів або з антитілом до Fas-рецептора гинуть що стали непотрібними видужали організму В-лімфоцити, продуценти антитіл, що несуть Fas-рецептор. FasL- ліганд, що відноситься до численного сімейства фактора некрозу пухлин TNF. Це сімейство гомотрімерних лігандів (тобто біологічно активних речовин (білків), що складаються з 3 однакових доменів (частин), крім FasL і TNFa. Включає TNFb (лімфотоксин).
Fas - член сімейства рецепторів TNF. Як говорилося вище, всі вони представлені трансмембранними білками, які позаклітинними ділянками взаємодіють з тримеру лігандів-індукторів. Взаємодія рецептора і ліганда призводить до утворення кластерів рецепторних молекул і зв'язування їх внутрішньоклітинних ділянок з адаптерами. Адаптер, зв'язавшись з рецептором, вступає у взаємодію з ефекторами, поки ще неактивними попередниками протеаз з сімейства каспаз першого ешелону (ініціюють каспаз).
Взаємодія адаптера з рецептором і ефекторів здійснюється через гомофільние білок-білкові взаємодії невеликих доменів: DD (death domain - домен смерті), DED (death-effector domain - домен ефектора смерті), CARD (- домен активації та рекрутування каспаз). Всі вони мають схожу структуру, містять по шість a-спіральних ділянок. Домени DD (домен смерті) беруть участь у взаємодії рецептора Fas c адаптером FADD (Fas-associated DD-protein). Домени DED беруть участь у взаємодії адаптера FADD з прокаспазу 8 і 10.
Найбільш докладно охарактеризована прокаспаза-8, рекрутіруемих рецептором Fas через адаптeр FADD. Утворюються агрегати FasL - Fas - FADD - прокаспаза-8. Подібні агрегати, в яких відбувається активація каспаз, названі апоптосомой. апоптоз нимішаперонамі. або сигнальними комплексами, індукують смерть.
Прокаспази мають незначну протеолітичної активністю, що становить 1-2% активності зрілої каспаз. Будучи в мономерний формі, прокаспази, концентрація яких в клітині незначна, перебувають у латентному стані. Передбачається, що просторове зближення молекул прокaспаз при їх агрегації веде до утворення активних каспаз через механізм протеолитического саме- і перехресного розщеплення (ауто- або транс-процесингу)]. В результаті від прокаспази (молекулярна маса 30-50 кДа) відокремлюється регуляторний N-кінцевий домен (продомен), а частина, що залишилася молекули розділяється на велику (
10 кДа) субодиниці (рис. 3). Потім відбувається асоціація великої і малої субодиниць. Два гетеродимера утворюють тетрамер з двома каталітичними ділянками, що діють незалежно один від одного. Таким чином прокаспаза-8 активується і вивільняється в цитоплазму у вигляді каспаз-8. Існують інші шляхи активації каспаз-8 - за участю рецепторів TNFR1 і DR3.
На етапі активації каспаз першого ешелону життя клітини ще можна зберегти. Існують регулятори, які блокують або, навпаки, посилюють руйнівну дію каспаз першого ешелону. До них відносяться білки Bcl-2 (інгібітори апоптоз а: A1, Bcl-2, Bcl-W, Bcl-XL, Brag-1, Mcl-1 і NR13) і Bax (промотори апоптоз а: Bad, Bak, Bax, Bcl -XS, Bid, Bik, Bim, Hrk, Mtd). Ці білки еволюційно консервативні: гомолог Bcl-2 виявлений навіть у губок, у яких апоптоз необхідний для морфогенезу.
Каспаза-8 активує каспаз другого ешелону (ефекторних каспаз): шляхом протеолізу з прокаспази-3 утворюється каспаза-3, після чого процес, запущений програмою смерті, виявляється незворотнім.
Каспаза-3 здатна надалі до самостійної активації (Автокаталіз або автопроцессінгу), активує ряд інших протеаз сімейства каспаз, активує фактор фрагментації ДНК, веде до незворотного розпаду ДНК на нуклеосомальние фрагменти. Так запускається каскад протеолітичних ферментів, які здійснюють апоптоз.