Саме в цьому простому рівнянні укладена фізична суть величини - універсальної газової постійної, рівної 8,31 Дж / (моль • К).
У ньому сp - молярна теплоємність при постійному тиску. а СV відповідно - в умовах постійного обсягу.
Молярна теплоємність вказує, скільки теплоти в Джоулях слід підводити до одного молю газу, щоб нагріти його на 1 Кельвін. Молярну теплоємність ізохоричного процесу можна визначити за такою формулою:
У практичних розрахунках часто використовують питому масову теплоємність, і якраз вона зазвичай наводиться в таблицях теплофізичних величин. Помноживши молярну теплоємність газу на його молярну масу, ми отримаємо питому масову теплоємність:
Навіщо взагалі знадобилося розмежовувати ізохорно і ізобарну теплоємності?
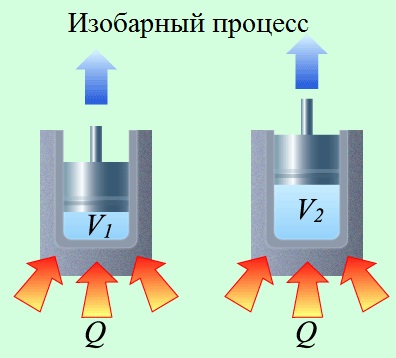
При изобарном процесі (процесі з постійним тиском) перший закон термодинаміки представляється формулою:
де - кількість теплоти, підведене до газу, - зміна внутрішньої енергії газу, - робота розширення, яку зробив газ.
А це значить, що теплота, підведена до газу в изобарном процесі, буде витрачена на зміну його внутрішньої енергії і роботу по його розширенню.
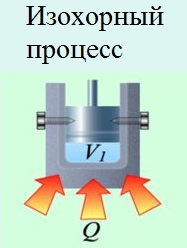
Якщо ж газ закрити в замкнутому об'ємі (ізохорний процес), то робота по його розширенню виконуватися не буде (), і вся підводиться теплота буде витрачена на зміну внутрішньої енергії:
Якщо від першого виразу відняти друге, отримаємо:
Таким чином, газова постійна R визначає роботу, витрачену на розширення одного моля газу при нагріванні його на 1 Кельвін при постійному тиску.
Приклади розв'язання задач
Молярна ізохорно теплоємність вуглекислого газу 28,825 Дж / (моль • К). Знайти теплоємність 1 л вуглекислого газу при постійному тиску.
Знаючи теплоємність 1 благаючи вуглекислого газу, знаходимо ізобарну теплоємність 1 л вуглекислого газу: