Найбільш простим і якісно вірно відображає поведінку реального газу. є рівняння Ван-дер-Ваальса:
(P + a / n 2) · (n - b) = R · T. (6.3)
а, b - постійні величини, перша враховує сили взаємодії, друга враховує розмір молекул.
a / n 2 - характеризує додатковий тиск. під яким знаходиться реальний газ внаслідок сил зчеплення між молекулами і називається внутрішнім тиском. Для рідких тел це тиск має великі значення (наприклад, для води при 20 0 С складає 1050 МПа), а для газів через малі сил зчеплення молекул воно дуже мало. Тому зовнішній тиск. під яким знаходиться рідина. надає незначна вплив на її обсяг, і рідина вважають нестисливої. У газах на увазі малості значення a / n 2 зовнішній тиск легко змінює їх обсяг.
Рівняння Ван-дер-Ваальса якісно вірно відображає поведінку рідких і газоподібних речовин. для двофазних станів воно не застосовується.
На PV - діаграмі (рис.6.1) показані ізотерми побудовані за рівнянням Ван-дер-Ваальса. З кривих видно, що при порівняно низьких температурах є хвилеподібні ділянки. Чим вище температура. тим коротше ці частини кривих. Ці хвилеподібні криві вказують на безперервний перехід від рідкого стану в пароподібний при даній температурі. Точка А відповідає стані рідини. точка В відноситься пароподібному стані речовини.
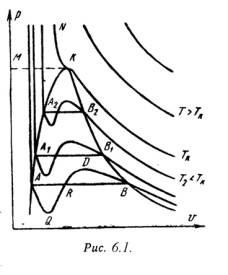
Насправді перехід з рідкого стану в пароподібний завжди відбувається через двофазне стан речовини. При цьому при даній температурі процес переходу відбувається також і при постійному тиску. Цей дійсний перехід з рідкого стану в пароподібний зображується прямою лінією АВ.
Практично для особливо чистих речовин можливе здійснення ділянок хвилеподібною кривою AQ і DB. У першому випадку мають місце нестійкі стану перегрітої рідини. а в другому - переохолодженого пара.
При певній температурі ізотерма рівняння Ван-дер-Ваальса не матиме хвилеподібного ділянки (точка К). Цю температуру називають критичною. Якщо з'єднати точки А1. А2. А3 ... і В1. В 2. У 3. отримаємо криву схожу на параболу. Крива АК називається нижньої прикордонної кривої і відповідає в стані кипіння рідини. Крива КВ називається верхньою прикордонної кривої і відповідає стану сухої насиченої пари.
Таким чином, для реального речовини PV - діаграму можна розбити на 3 області:
1 - область рідкого стану, розташована лівіше нижньої прикордонної кривої;
2 - область двофазних станів (вологий пар), розташована між нижньою і верхньою прикордонної кривої);
3 - область перегрітої пари. розташована правіше верхньої прикордонної кривої і вище критичної точки. Умовно область рідини обмежують зверху лінією КМ - критична ізобара.
Зв'язок між критичними параметрами і постійними рівняння Ван-дер-Ваальса:
Рівняння Ван-дер-Ваальса при великій щільності газу дає значні помилки. Крім цього експериментальним шляхом доведено, що коефіцієнти а, b залежать від температури і тиску. причому ця залежність дуже складна.
М.П.Вукаловіч і І.І.Новіков в 1939 р запропонували нове універсальне рівняння стану реальних газів з урахуванням асоціації і дисоціації їх молекул. який має наступний вигляд:
(P + a / n 2) · (n - b) = R · T (1 - З / (n · Т (3 + 2m) / 2), (6.6)
С, m - постійні, які визначаються на підставі досвідчених даних.