Якщо осадитель летючий, то рекомендується використовувати двох - триразовий його надлишок; якщо осадитель нелеткий, використовують 30-50% надлишок.
Обчислити об'єм 2% розчину нітрату срібла щільністю 1г / мл, необхідного для осадження хлорид-аніону з зразка CaCl2 • 6H2O масою 0,4382 р
Знаходимо масу нітрату срібла, необхідну для осадження хлорид-аніону у вигляді хлориду срібла.
Використовуємо закон еквівалентів:
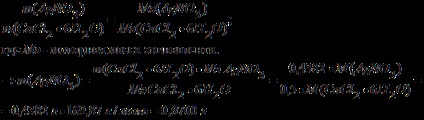
Знайдемо масу 2% -го розчину нітрату срібла:
Обсяг розчину дорівнює масі розчину, т. К. Щільність розчину 1 г / мл. Отже, обсяг розчину дорівнює 34,00 мл.
Який обсяг 5% -го розчину нітрату срібла щільністю 1 г / мл потрібно для осадження хлориду срібла з 200 мл 0,01 М розчину соляної кислоти.
Знаходимо масу соляної кислоти в 200 мл 0,01 М розчину.
Знаходимо масу нітрату срібла по закону еквівалентів:
Знаходимо масу 5% -го розчину нітрату срібла.
Обсяг 5% -го розчину дорівнює масі розчину, т. К. Щільність розчину дорівнює 1г / мл. Отже, обсяг розчину дорівнює 6,8 мл.
Для більш повного осадження береться 30% надлишок осадителя:
Vраствора = 6,8 мл • 1,3 = 8,84 мл.
Обчислити масу 5% -го розчину сірчаної кислоти для осадження свинцю з 0,5865 г зразка з масовою часткою свинцю 12%.
Знаходимо масу свинцю в зразку:
Знаходимо масу чистої сірчаної кислоти для осадження свинцю. Використовуємо закон еквівалентів:
Знаходимо масу 5% -го розчину сірчаної кислоти:
Визначити обсяг 2% -го розчину 8-гідроксихінолін щільністю 1г / мл, взятого з 10% надлишком, для повного осадження 8-гідроксіхінолята магнію з 100 мл розчину, що містить 50 мг магнію.
Кількість осадителя можна знайти за законом еквівалентів або за рівнянням реакції:
MgCl2 + 2C9H6NOH Mg (C9H6NOH) 2 + 2HCl
Розраховуємо обсяг розчину осадителя:
Маса розчину дорівнює об'єму розчину, т. К. Щільність 1 г / мл. Отже, обсяг розчину дорівнює 7,5 г • 1 г / мл = 7,5 мл. Обсяг розчину осадителя, взятого з 10% надлишком дорівнює 7,5 мл • 1,1 = 8,25 мл.