У звичайному житті слово електроліз ми чуємо досить часто. Але, далеко не всі знають, що воно означає.
Електроліз - це фізико-хімічний процес. В ході якого відбувається проходження постійного електричного струму через електроліт. При електролізі позитивно заряджений електрод має назву - анод. А, негативно заряджений - катод. Рухомі частинки в електроліті називаються іонами. В ході процесу електролізу позитивні іони - катіони -двіжутся до катода, негативні іони - аніони - рухаються до анода.
Найчастіше в звичайному житті під словом електроліз на увазі електроліз води. Це процес при якому за допомогою електричного струму воду розкладають на водень і кисень. І він описується наступною хімічною реакцією.
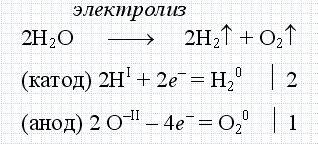
Процес електролізу, дуже широко застосовується в техніці і промисловості. Наприклад, виключно, за допомогою електролізу, сьогодні проводиться алюміній. Саме, тому це виробництво пов'язане з великими витратами електроенергії.
Основними фізичними законами, якими описується електроліз є закони Фарадея.
У 1832 році Фарадей встановив, що маса m речовини, яка виділяється на електроді, прямо пропорційна електричному заряду q, що пройшов через електроліт:
якщо через електроліт пропускається протягом часу t постійний струм з силою струму I.
коефіцієнт пропорційності
k називається електрохімічним еквівалентом речовини. Він чисельно дорівнює масі речовини, яка виділяється при проходженні через електроліт одиничного електричного заряду, і залежить від хімічної природи речовини.
Цей закон отримав назву - Перший закон Фарадея.
Другий закон Фарадея:
Хімічним еквівалентом іона називається відношення молярної маси A іона до його валентності z. Тому електрохімічний еквівалент.
Другий закон Фарадея записується в наступному вигляді:
де
M - молярна маса даної речовини, що утворився (проте не обов'язково виділився - воно могло і вступити в яку-небудь реакцію відразу після утворення) в результаті електролізу, г / моль;
I - сила струму, пропущеного через речовину або суміш речовин (розчин, розплав), А;
t - час, протягом якого проводився електроліз, с;
F - постійна Фарадея, Кл · моль-1;
n - число що беруть участь в процесі електронів, яке при досить великих значеннях сили струму дорівнює абсолютній величині заряду іона (і його протівоіона), який прийняв безпосередню участь в електролізі (окисленого або відновленого). Однак це не завжди так; наприклад, при електролізі розчину солі міді (II) може утворюватися не тільки вільна мідь, але і іони міді (I) (при невеликій силі струму).