Сорбція (від лат. Sorbeo - поглинаю) - поглинання твердим тілом або рідиною різних речовин з навколишнього середовища. Поглинається речовина, що знаходиться в середовищі, називають сорбатом (сорбтівом), що поглинає тверде тіло або рідина - сорбентом.
За характером поглинання сорбата сорбційні явища діляться на два типи: адсорбцію - концентрування сорбата на поверхні розділу фаз або його поглинання поверхневим шаром сорбенту і абсорбцію - об'ємне поглинання, при якому сорбат розподіляється по всьому об'єму сорбенту.
У свою чергу, розрізняють два типи адсорбції - фізичну адсорбцію, при якій підвищення концентрації сорбата на поверхні розділу фаз зумовлено неспецифічними (тобто не залежать від природи речовини) силами Ван-дер-Ваальса і хімічну адсорбцію (хемосорбцію), обумовлену протіканням хімічних реакцій сорбата з речовиною поверхні сорбенту. Фізична адсорбція слабоспеціфічна, оборотна і її тепловий ефект невеликий (одиниці кДж / моль). Хемосорбція вибіркова, зазвичай незворотна і її теплота становить від десятків до сотень (хемосорбция кисню на металах) кДж / моль.
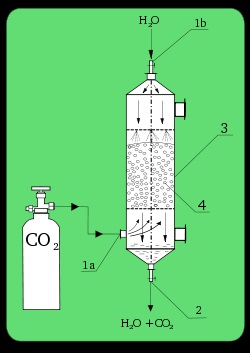
Лабораторний абсорбер. 1a). впуск CO2; 1b): впуск H2 O; 2). випуск; 3). абсорбційна колона; 4). наповнювач.
Абсорбція в хімії - фізичний або хімічний феномен або процес. при якому атоми. молекули або іони входять в какоё-небудь об'ємне стан - газ. рідина або тверде тіло. Це процес, відмінний від адсорбції. оскільки молекули, котрі піддаються абсорбції, забираються за обсягом, а не по поверхні (як відбувається у випадку з адсорбцією). Більш загальний термін - сорбція, який охоплює процеси абсорбції, адсорбції та іонного обміну. Абсорбція, в основному - це процес, при якому щось приєднує іншу субстанцію. [1]
Якщо абсорбція є фізичним процесом, не що супроводжується іншими фізичними або хімічними процесами, вона зазвичай підкоряється закону розподілу Нернста:
"При рівновазі відношення концентрацій третього компонента в двох рідких станах є постійною величиною.";
Обсяг постійної KN залежить від температури і називається коефіцієнтом розподілу. Це рівність вірно за умови, що концентрації не надто великі і якщо молекули "х" не змінюють свою форму в будь-якому іншому з двох станів. Якщо така молекула піддається асоціації або дисоціації. тоді це рівність все так же описує рівновагу між "х" в обох станах, але тільки для тієї ж форми - концентрації всіх, хто лишився форм повинні бути розраховані з урахуванням всіх інших рівноваг. [1]
У разі газової абсорбції можна розрахувати концентрацію використовуючи наприклад Закон ідеального газу. c = p / RT. В якості альтернативи можна використовувати парціальний тиск замість концентрацій.
У багатьох технологічно важливих процесах, хімічна абсорбція використовується замість фізичного процесу, наприклад абсорбція вуглекислого газу гідроксидом натрію - такі процеси не діють за законом розподілу Нернста.
Для деяких прикладів цього ефекту можна розглянути екстракцію. при якій можна витягти компонент з однієї рідкої фази розчину і перенести в іншу без хімічної реакції. Приклади таких розчинів - благородні гази і оксид осмію. [1]