Далеко не всі органічні речовини мають кольором. Однак у тих речовин, які мають забарвлення, в структурі молекул є принципове схожість. Всі вони, як пра-вило, великі молекули, що складаються з десятків атомів. Для виникнення кольору мають значення не електрони окремих атомів, а стан системи електронів, що охоплює всю молекулу цілком. Рухливість такої системи, її здатність легко змінювати свій стан під невеликим впливом світлових квантів і обумовлений-кість виборче поглинання певних хвиль з на-бору, що становить видиме світло.
Щоб зрозуміти залежність кольоровості від будови, нуж-но розглянути, в чому полягають особливості енергетичного стану електронів того чи іншого типу молекул.
Спектри поглинання і колір неорганічних речовин
Той чи інший колір речовини означає, що з усього інтервалу 400-700 нм довжин хвиль пиляємо світла їм поглинутої частішають якісь певні кванти, енергія яких у загальному-то невелика.
З цього в свою чергу випливає, що в молекулах окра-шенних речовин енергетичні рівні електронів досить близько розташовані один до одного. якщо різниця # 916; Е велика, то вживаються інші кванти, що несуть більше енергії, наприклад, ультрафіолетові. Такі ве-щества, як азот, водень, фтор, благородні гази, ка-жутся нам безбарвними. Кванти видимого світла не поглинутої частішають ними, так як не можуть привести електрони на бо-леї високий збуджений рівень. Якби наші очі здатні були сприймати ультрафіолетові промені, то в такому ультрафіолетовому світлі і водень, і азот, і інертний-ні гази здавалися б ним пофарбованими.
Чим більше електронів в атомі, тим тісніше один до дру-гу електронні рівні. Особливо добре, якщо в атомі є незайняті електронами орбіти. У такому випадку для переходу електрона з одного стану в інший вимагають-ся кванти світла вже з меншою енергією, яку несуть промені видимої частини спектру. Такі Багатоелектронні га-логени, як хлор, бром, йод, вже пофарбовані. Мають окрас-ку оксиди азоту NО2, N2О3 і ковалентні сполуки, на-приклад CuCl2, AlI3. Забарвлення молекул (рис. 1.), що складаються з декількох атомів, залежить від цілого ряду чинників. Якщо дію цих чинників таке, що вони зближують електронні рівні, то це сприяє появі або поглибленню забарвлення. Так більш тісний контакт атомів при переході з газоподібного в рідкий і далі твердий стан може сприяти появі або
поглибленню кольору, особливо в тих випадках, коли у атомів є незайняті електронами орбіти.
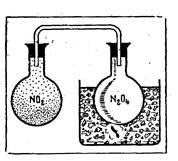
Мал. 1. Забарвлення оксиду азоту (IV) зникає при охолодженні (утворюється димер N2O4) і знову з'являється при нагре-вання.
Різниця в характері вза-імодействія позначається на спектрах. Спектри поглинання найпростіших молекулярну-них з'єднань - газів і речовин в газоподібному стані - складаються з не-скількох серій вузьких смуг (ліній). Це означає, що з усього потоку білого світла вони вибирають лише деякі фотони, енергія яких якраз дорівнює різниці між основним і "порушеними" станами електро-нів. У рідкому і особливо твердому стані спектр стає по суті суцільним, так як через сильний взаємодії близько розташованих атомів з'являється багато нових енергетичних рівнів електро-нів і, отже, збільшуються можливості нових електронних переходів, зростає число рівнів енергії мо-лекул і іонів. В спектр входить велика кількість широких смуг, що тягнуться на кілька десятків наномет-рів. Інтенсивність смуг і їх різне накладення друг на друга визначає підсумковий колір речовини. Адже при раз-особистих поєднаннях основних кольорів: червоного, синього, зе-леного або червоного, жовто-го, синього получа-ються всі інші кольори спік-тра.
Як правило, смуги по-глощенія у неорганічних речовин починаються в віді-мій області, а закінчуються в ультрафіолетової. Положення найбільш інтенсивних по-лос поглинання і визначає колір (табл. 1.).

Колір речовини складається з суми відображених хвиль (або минулих речовина без затримки), причому інтенсивність тих чи інших хвиль може бути різна. Тому навіть якщо спектр складається з одних і тих же хвиль, але їх відносна частка в спектрі змінена, то ми бачимо речовини різного кольору. Промені, комбінуючи в спектрі один з одним, дадуть різне забарвлення. Ось приклад. Кадмій і ртуть - елементи однієї і тієї ж підгрупи II групи періодічоской системи. Їх атоми відрізняються один від одного числом внутрішніх електронів. Їх сульфіди HgS і CdS сильно поглинають промені фіолетовою частини спектра і значно слабкіше - червоно-помаранчевої (рис. 2.). В результаті, здавалося б, незначну різницю у відображенні виходить вже інша комбінація: сульфід кадмію виявляється жовтим, а сульфід ртуті - помаранчевим.
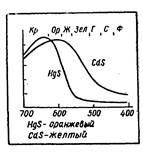
Рис.2. Різниця в спектрах поглинання визначає колір.
На діаграмі приведені спектри декількох речовин, у яких різна інтенсивність відбиття хвиль різних ділянок видимого світла. На малюнку 3 зазначено, при яких співвідношеннях ми бачимо той чи інший колір. У тому випадку, якщо криві перетинаються, кольори взаємно "знищують" один одного і ми бачимо тільки той колір, який залишається. При відображенні кольору з довжиною хвилі 480 нм речовина синє, так як взаємно будете знищені червоний і зелений кольори. При 500 нм - зелене, вище 600 нм - червоне з жовтуватим відтінком. Кольорове відчуття від різних ок-расок (отримується, наприклад, при накладенні кольорових сте-кол) сприймається нами як сумарне.
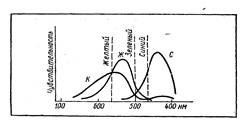
Мал. 3. Відомий колір є результат накладення основних кольорів, що відповідають трьом нервовим центрам, що створюють відчуття червоного, зеленого і синього.
Особливості твердого стану неорганічних барвників
В першу чергу слід пам'ятати, що неорганічні барвники, як природні, так і синтетичні, - кристал-вої тіла. Особливістю їх є впорядковане розташування багатьох сотень і тисяч атомів, іонів або мо-лекул. Розрізняються вони як за типом входять до тверде тіло частинок, так і за типом хімічних зв'язків між ними.
Для того щоб зрозуміти їх структуру, розглянемо на зна-комих зі шкільного курсу хімії прикладах особливості того чи іншого виду побудови агрегатних станів.
У газоподібному стані речовини характеризуються значними відстанями між частинками і малими силами взаємодії між ними. Вони здатні зани-мати будь-який наданий обсяг, і їх властивості в основ-ному визначаються поведінкою окремих частинок. У жид-кого ж стані частки речовин зближені на расстоя-ня, співмірні з їх розмірами, сили взаємодії між частинками значні. Частинки речовини об'єд-ються в більші агрегати, в яких їх взаємне розташування впорядковане і рух носить коливальний характер (ближній порядок). На значних расстоя-ниях від центрів агрегатів (дальній порядок) ця впорядкованість порушується. Міцність зв'язків між агрегатами частинок в рідині невелика, тому в рідкому стані речовина займає певний обсяг, але здатне змінювати форму під дією сили тяжіння. Поведінка речовин в цьому стані визначає-ся як властивостями частинок і їх агрегатів, так і взаємодій-ствиями між ними.