4.Спіновое квантове число. позначається (ms), не пов'язане з характеристикою атомної орбіталі, а умовно характеризує власне обертання електрона навколо своєї осі; воно може приймати тільки два значення: 1/2 і -1/2, що відрізняються один від одного, так само як і значення інших квантових чисел, на одиницю.
Перші три квантових числа характеризують орбіталь, на якій знаходиться даний електрон; четверте квантове число характеризує поведінку електрона на цій орбіталі.
Загальна характеристика стану електрона в багатоелектронних атомі регулюється принципом, який був сформульований в 1925 р Вольфгангом Паулі (1900-1958).
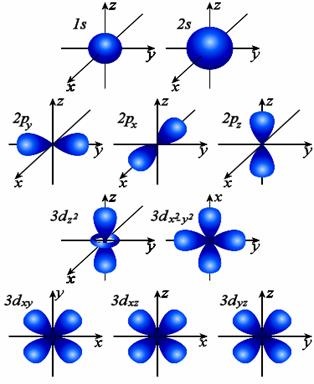
Мал. 1. Форми і орієнтація в просторі електронних хмар 1s -, 2s-, 2р - і 3d - орбіталей
в атомі не може бути двох електронів з однаковими квантовими числами.
Це означає, що на орбіталі, яка характеризується трьома квантовими числами, не може бути більше двох електронів. Два електрона, що знаходяться на одній орбіталі, відрізняються один від одного значеннями спинового квантового числа, тобто характеризуються протилежними, або антипаралельними, спинами і називаються спареними. Така електронна пара, що знаходиться на одній орбіталі, схематично зображується протилежно спрямованими стрілками, тоді як одиночний, тобто неспарених електронів на будь-якої орбіталі зображується однією стрілкою.
Електрон в атомі прагне зайняти місце з найменшим запасом енергії.
Визначити енергетичну вигідність місця в атомі дозволяє правило Клечковского:
енергетична вигідність місця визначається найменшою сумою головного і побічного квантових чисел (n + l), в разі, якщо ця сума однакова, електрони заповнюють підрівні з меншим числом n.
Виходячи з правила Клечковского, електрони будуть заповнювати підрівні в наступній послідовності:
1s 2 2s 2 2р 6 3s 2 3р 6 4s 2 3d 10 4р 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 6f 14 7p 6
Приклад 12. Записати електронну формулу атома 18 Ar. Визначити кількість рівнів, підрівнів, валентних електронів.
Записати: електронну формулу атома 18 Ar
1.Ісходя з правила Клечковского електрони будуть заповнювати підрівні в наступній послідовності: 1s 2 2s 2 2р 6 3s 2 3р 6 (електронна формула атома Ar).
2.Кількість рівнів в атомі Ar - 3.
3.Подуровні атома Ar - (s, p).
число електронів 18 Aг 1s 2 2s 2 2р 6 3s 2 3р 6. валентні електрони: 3s 2 3р 6.
Відповідь: Електронна формула 18 Aг 1s 2 2s 2 2р 6 3s 2 3р 6. кількість рівнів в атомі Ar - 3; s-, р-підрівні, валентні електрони: 3s 2 3р 6.
Заповнення орбіталей електронами в межах одного підрівня відбувається згідно з правилами Гунда.
1-е правило Гунда. в даному підрівні електрони прагнуть заповнювати енергетичні стану таким чином, щоб сумарний спин був максимальним.
2-е правило Гунда. мінімальною енергією володіє стан з максимальною сумою магнітних квантових чисел.
Під хімічним зв'язком розуміються різні види взаємодій, що обумовлюють стійке існування двох- і багатоатомних сполук: молекул, іонів, кристалічних та інших речовин.
Хімічна зв'язок, утворена шляхом усуспільнення пари електронів двома атомами, називається ковалентним зв'язком.
Для опису хімічних зв'язків в даний час найбільшого поширення набули спрощені подуемпіріческіе методи - метод валентних зв'язків (MBC) і метод молекулярних орбіталей (MMO). В основі цих методів лежать уявлення квантової механіки.
MBC передбачає. що взаємодія між атомами здійснюється тільки за рахунок неспарених електронів.
Основні положення МВС:
а) хімічний зв'язок між двома атомами виникає як результат перекривання АО з утворенням електронних пар;
б) атоми, що вступають в хімічний зв'язок, обмінюються між собою електронами, які утворюють зв'язують пари. Енергія обміну електронами між атомами (енергія тяжіння атомів) вносить основний вклад в енергію хімічного зв'язку. Додатковий внесок в енергію зв'язку дають кулонівських сили взаємодії частинок;
в) відповідно до принципу Паулі хімічний зв'язок утворюється лише при взаємодії електронів з антипаралельними спинами;
г) характеристики хімічного зв'язку (енергія, довжина, полярність і ін.) визначаються типом перекривання АО.
Загальні електронні пари можуть бути утворені:
а) за обмінним механізмом;
б) по донорно-акцепторного механізму.
Обмінний механізм - загальна електронна пара утворюється з неспарених електронів обох взаємодіючих атомів.
Так, утворення молекул Н2. Cl2 можна представити таким чином:
Схема 1. Електронні схеми молекул H2. Cl2
При утворенні електронних пар кількість електронів на зовнішньому шарі збільшується у обох атомів.
Для спрощеної і наочної записи використовують валентні схеми. в яких кожна загальна електронна пара позначається рискою.
Якщо при утворенні молекули використаний тільки обмінний механізм утворення зв'язку, то валентна схема по виду збігається зі структурною формулою сполуки.
Донорно-акцепторні механізм - зв'язок утворюється за рахунок електронної пари одного з атомів і вільної орбіталі іншого.
Таким чином, сумарна валентність елемента дорівнює числу неспарених електронів (обмінний механізм) і числу зв'язків, утворених за донорно-акцепторного механізму.
Залежно від характеру перекривання електронних хмар розрізняють # 963; - (сигма -), π - (пі) і # 948; - (дельта) зв'язку (рис.2).
Сигма-зв'язок (# 963;)-зв'язок. утворена перекриванням АТ по лінії, що з'єднує ядра взаємодіючих атомів (рис.3).
# 963;-зв'язок може виникати при перекривання s -орбіталей, s- і p орбіталей, р -орбіталей, d орбіталей, d - і s -орбіталей, d- і р -орбіталей і f -орбіталей один одним, а також при перекривання гібридних орбіталей.
Зв'язок, утворена перекриванням d орбіталей усіма чотирма пелюстками, називається # 948; -зв'язком (рис. 5).
Малюнок 5. Напрями перекривання атомних d орбіталей,
Властивості ковалентного зв'язку
1.Направленность ковалентного зв'язку. Спрямованість зв'язку визначається типом гібридизації АТ. В освіті ковалентних зв'язків передбачається участь не тільки «чистих» атомних орбіталей (АО), але і «змішаних», так званих гібридних, АТ. При гібридизації первісна форма і енергія орбіталей (електронних хмар) взаємно змінюються і утворюються орбіталі (хмари) нової однакової форми і однакової енергії. Число гібридних орбіталей (q) дорівнює числу вихідних. Будова молекул типу АВ в залежності від типу гібридизації показано в табл. 6.
Якщо в гібридизації беруть участь одна s- і одна p-орбіталі (sp-гібрид-зація), то утворюються дві рівноцінні sp-орбіталі; з однієї s- і двох p-орбіталей (sp 2-гібридизація) утворюються три sp 2 орбіталі і т.д.
Гібридні хмари, які відповідають даному типу гібридизації, розташовуються в атомі так, щоб взаємодія між електронами було мінімальним, тобто якомога далі один від одного. Тому при sp-гібридизації електронні хмари орієнтуються в протилежних напрямках. При sp 2-гібридизації - в напрямках, що лежать в одній площині і складових один з одним кути в 120 ° (тобто в напрямках до вершин правильного трикутника), при sp 3-гібридизації - до вершин тетраедра (кут між цими напрямками становить 109 ° 28 '), при sp 3 d 2-гібридизації - до вершин октаедра (тобто по взаємно перпендикулярним напрямам).
Кількісно спрямованість виражається у вигляді валентних кутів між напрямками хімічного зв'язку в молекулах і твердих тілах.
2.Насищаемость ковалентного зв'язку викликається обмеженням числа електронів, що знаходяться на зовнішніх оболонках, які можуть брати участь в утворенні ковалентного зв'язку. Наприклад, у водню 1 електрон, отже, одна зв'язок. Тому можливо H2. але не H3.
3.Полярность ковалентного зв'язку. Якщо ковалентний зв'язок утворена однаковими атомами, наприклад H-H, O = O, Cl-Cl, N≡N, то усуспільнені електрони рівномірно розподілені між ними.
Такий зв'язок називається ковалентним неполярной зв'язком. Якщо ж один з атомів сильніше притягує електрони, то електронна пара зміщується в бік цього атома. В цьому випадку виникає полярна ковалентний зв'язок.
Внаслідок зсуву електронної пари до одного з ядер, підвищується щільність негативного заряду у даного атома і відповідно атом отримує заряд, званий ефективним зарядом атома # 948; -. У другого атома підвищується щільність позитивного заряду # 948; +.
Зсув електронів і полярність зв'язку тим більше, чим більше різниця в електронегативності взаємодіючих елементів.