Тема: «Будова І ФУНКЦІЇ СКЛАДНИХ БІЛКІВ. СТРУКТУРА І ФУНКЦІЇ міоглобіну І ГЕМОГЛОБІНУ »
1. Визначення поняття і основні принципи класифікації складних білків. Приклади.
2. Глікопротеїни: особливості будови, приклади, функції. Імуноглобуліни: особливості будови, класи імуноглобулінів, їх роль в організмі.
3. Фосфопротеіни: представники, зв'язування простетичної групи з апопротеина, роль в організмі.
4. металопротеїни: представники, характер простетичної групи, її зв'язування з апопротеина, роль металопротеїни в організмі.
5. Будова і функції хромопротеїни (на прикладі міоглобіну і гемоглобіну). Аллостерічеськіє властивості гемоглобіну. Кооперативний ефект. Роль СО 2. водневих іонів і 2,3-дифосфоглицерата в регуляції спорідненості гемоглобіну до кисню.
6. Похідні гемоглобіну (дезоксигемоглобін, оксигемоглобін, карбгемоглобін, карбоксигемоглобин, метгемоглобін, ціанметгемоглобін), їх характеристика. Причини і наслідки накопичення метгемоглобіну в крові.
7. Молекулярні форми гемоглобіну. Фетальний гемоглобін, особливості структури, властивості, біологічна роль. Серповидно-клітинну гемоглобін (HbS), особливості структури, властивості, прояви гемоглобиноза S.
Поняття про простих і складних білках. Класифікація складних білків.
3.2.1.Ліпопротеіни - складні білки, що містять в якості простетичної групи ліпіди і їх похідні. Представниками служать хиломікрони і інші фракції ліпопротеїнів крові. Ліпопротеїни є транспортними формами ліпідів в крові. Більш детально цей клас складних білків розглядається в розділі «Обмін ліпідів».
3.2.2.Нуклеопротеіни - складні білки, що містять в якості простетичної групи нуклеїнові кислоти. Нуклеопротеїн є віруси, рибосоми, хроматин клітинного ядра. Існують два різновиди нуклеопротеинов: 1) рибонуклепротеіну. до складу яких входить рибонуклеїнова кислота (РНК); 2) дезоксірібонуклеопротеіни. до складу яких входить дезоксирибонуклеїнової кислоти (ДНК). Будова і властивості нуклеїнових кислот будуть розглядатися пізніше.
Особливість білкової частини нуклеопротеїнів полягає в тому, що в її склад входить багато позитивно заряджених амінокислотних залишків. Так, до складу дезоксірібонуклеопротеінов входять білки гістони, багаті на лізин і аргінін. Між білковими і небілковими компонентами нуклеопротеинов утворюються іонні зв'язку (так як нуклеїнові кислоти заряджені негативно).
3.2.3. Фосфопротеіни містять в своєму складі залишки фосфорної кислоти, з'єднані з залишками гідроксиамінокислота (серин, треонін) за допомогою складноефірних зв'язків. До цієї групи складних білків відносяться казеиноген молока, яєчні білки овальбумин і вителлин. Багато внутрішньоклітинні білки є Фосфопротеіни. Приєднання фосфатної групи до білка часто викликає зміна його функції.
Фосфорилювання і зворотний процес - дефосфорілірованіе - поширений механізм регуляції біологічної активності білків. Наприклад, фосфорилювання гістонів знижує їх здатність зв'язуватися з ДНК і брати участь в регуляції матричних синтезів за участю ДНК.
3.2.4. Металопротеїни. Якщо в білку містяться іони одного або декількох металів, то такі білки називаються металопротеїни. Іони металів з'єднані координаційними зв'язками з функціональними групами білка і беруть участь в підтримці його просторової структури. Металопротеїни часто є ферментами.
Трансферрин - водорозчинний железопротеін, що міститься в сироватці крові в складі β-глобулінів. Молекула трансферрина містить 2 іона Fe 3+; цей білок служить переносником заліза в організмі.
Ферритин - внутрішньоклітинний глобулярний білок, міститься головним чином в селезінці, печінці, кістковому мозку, виконуючи роль депо заліза в організмі. Завдяки феритину цитозольні запаси заліза підтримуються в розчинній і нетоксичного формі.
Гемосидерин. на відміну від феритину і трансферину, є водонерозчинних железосодержащим білковим комплексом. Він міститься головним чином в клітинах печінки і селезінки, накопичується при надлишку заліза в організмі, наприклад, при частих переливанні крові.
Церулоплазмін - білок α 2 -глобулінової фракції сироватки крові, його молекула містить 6 - 8 іонів міді. Володіє каталітичної активністю, каталізує реакцію окислення Fe 2+ в Fe 3+. Це робить можливим зв'язування заліза з трансферином і його подальший транспорт в крові.
Будова і функції гликопротеинов. Імуноглобуліни.
3.3.1. Глікопротеїни - містять в якості простетичної групи вуглеводи і їх похідні. Вони приєднуються або N-гликозидной зв'язком до амідогруппе залишку аспарагіну, або О-гликозидной зв'язком до гідроксигрупа залишку серину або треоніну. Вуглеводна частина має нерегулярне будова.
Глікопротеїни виконують в організмі такі функції: структурну (колаген, еластин), захисну (антитіла, інтерферони), рецепторну, гормональну (гормони гіпофіза), ферментативну, транспортну.
3.3.2. Імуноглобуліни (антитіла) - група білків, що виробляються організмом у відповідь на потрапляння в організм чужорідних структур (антигенів). Вони синтезуються В-лімфоцитами або плазматичними клітинами. В організмі може вироблятися близько 107 різновидів імуноглобулінів, кожен з яких може розпізнавати певний антиген. Все імуноглобуліни поділяють на п'ять класів: IgA, IgG, IgM, IgD, IgE.
Основну структурну одиницю імуноглобулінів, або мономер, утворюють чотири поліпептидні ланцюги, з'єднані між собою дисульфідними зв'язками, з них:
а) дві ідентичні важкі ланцюги (молекулярна маса 53000 - 75000 Да), що позначаються буквами Н;
б) дві ідентичні легкі ланцюга (молекулярна маса близько 23000 Да), що позначаються буквами L.
Імуноглобуліни G, D і Е по своїй структурі, як правило, є мономерами, молекули IgM побудовані з п'яти мономерів, IgA можуть бути як мономерами, так і складатися з двох і більше структурних одиниць.
Білкові ланцюги, що входять до складу імуноглобулінів, можна умовно розділити на специфічні домени, або області, що мають певні структурні і функціональні особливості.
N-кінцеві ділянки як L-, так і Н-ланцюгів називаються вариабельной областю (V), так як їх структура характеризується істотними відмінностями у різних класів антитіл. Усередині вариабельного домену є 3 гіперваріабельних ділянки, що відрізняються найбільшою різноманітністю амінокислотноїпослідовності. Саме вариабельная область антитіл відповідальна за зв'язування антигенів за принципом комплементарності; первинна структура білкових ланцюгів в цій області визначає специфічність антитіл.
С-кінцеві домени Н і L-ланцюгів мають відносно постійною первинної структурою в межах кожного класу антитіл і називаються константною областю (С). Константна область визначає властивості різних класів імуноглобулінів, їх розподіл в організмі, може брати участь у запуску механізмів, що викликають знищення антигенів.
3.3.3.Функціі імуноглобулінів. IgG складають близько 75% загальної кількості імуноглобулінів плазми крові. IgG ефективно пов'язують і інактивують чужорідні молекули і клітини, що потрапили в організм, а також полегшують їх подальше знищення, здатні долати плацентарний бар'єр, що забезпечує імунітет новонароджених протягом перших тижнів життя.
IgA містяться головним чином в секретах слизових оболонок дихальних і видільних шляхів, шлунково-кишкового тракту, тобто забезпечують захист поверхонь, сполучених із зовнішнім середовищем.
IgM синтезуються на ранніх стадіях імунної відповіді, вступають в реакцію аглютинації з антигенами, активують систему комплементу.
IgD пов'язані з мембраною лімфоцитів, функціонують як рецепторів для антигенів.
IgE беруть участь в розвитку алергічних реакцій, в захисті від паразитарних інвазій.
3.4.1. Серед хромопротеїни розрізняють гемопротеїни (містять в якості простетичної групи порфіринові похідні) та флавопротеїни (містять похідні рибофлавіну - вітаміну B 2). Хромопротеїни беруть участь в здійсненні багатьох життєво важливих функцій, таких як тканинне дихання, перенесення кисню, окислювально-відновні реакції, светоощущеніє, фотосинтез в рослинних клітинах і інші процеси.
3.4.2. До гемопротеинов відносяться: гемоглобін, міоглобін, цитохроми, пероксидаза, каталаза. Ці білки містять як простетичної групою гем.
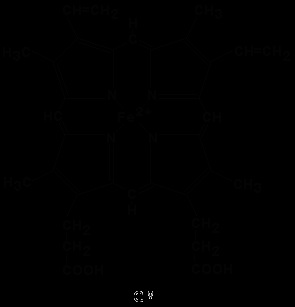
За своєю хімічною будовою гем являє собою протопорфирин IX. пов'язаний з двовалентних залізом. Протопорфирин IX - органічна сполука, що відноситься до класу порфиринов. Протопорфирин IX містить чотири заміщених піррольних кільця, з'єднаних метинового містками = СН-. Заступниками в піррольних кільцях є: чотири метильние групи СН 3 -. дві вінільні групи СН 2 = СН-і два залишку пропіонової кислоти - СН 2-СН 2 -СООН. Гем з'єднується з білкової частиною наступним чином. Неполярні групи. протопорфирина IX взаємодіють з гідрофобними ділянками амінокислот за допомогою гідрофобних зв'язків. Крім того, є координаційна зв'язок між атомом заліза і імідазольним радикалом гистидина в білкової ланцюга. Ще одна координаційна зв'язок атома заліза може використовуватися для зв'язування кисню та інших лігандів.
Присутність в біологічному матеріалі гемсодержащих білків виявляється за допомогою бензидинової проби (при додаванні бензидина і пероксиду водню досліджуваний розчин забарвлюється в синьо-зелений колір).
3.4.3. Порівняйте структуру і функцію міоглобіну і гемоглобіну, запам'ятайте характерні особливості кожного з цих білків.
Міоглобін - хромопротеїни, присутній в м'язовій тканині і володіє більшою спорідненістю до кисню. Молекулярна маса цього білка близько 16000 Так, Молекула міоглобіну має третинну структуру і являє собою одну поліпептидний ланцюг, з'єднану з гемом. Міоглобін не володіє аллостеріческого властивостями (див. 2.4.), Крива насичення його киснем має вигляд гіперболи (рисунок 4). Функція міоглобіну полягає в створенні в м'язах кисневого резерву, який витрачається в міру необхідності, заповнюючи тимчасовий брак кисню.
Гемоглобін (Hb) - хромопротеїни, присутній в еритроцитах і бере участь в транспорті кисню до тканин. Гемоглобін дорослих людей називається гемоглобіном А (Hb A). Молекулярна маса його становить близько 65000 Так. Молекула Hb А має четвертинних структуру і включає чотири субодиниці - поліпептидні ланцюга (позначаються α 1. α 2. β 1 і β 2. кожна з яких пов'язана з гемом.
Запам'ятайте, що гемоглобін відноситься до аллостерическим білків, його молекули можуть зупинити переходити з однієї конформації в іншу. При цьому змінюється спорідненість білка до лигандам. Конформація, що володіє найменшим спорідненістю до ліганду, називається напруженою, або Т-конформацией. Конформація, що володіє найбільшим спорідненістю до ліганду, називається релаксированной, або R-конформацией.
R- і Т-конформації молекули гемоглобіну знаходяться в стані динамічної рівноваги:
Різні чинники середовища можуть зрушувати цю рівновагу в ту чи іншу сторону. Аллостеріческого регуляторами, що впливають на спорідненість Hb до O 2. є: 1) кисень; 2) концентрація Н + (рН середовища); 3) вуглекислота (СО2); 4) 2,3-дифосфоглицерата (ДФГ). Приєднання молекули кисню до однієї з субодиниць гемоглобіну сприяє переходу напруженої конформації в релаксувати і підвищує спорідненість до кисню інших субодиниць тієї ж молекули гемоглобіну. Це явище отримало назву кооперативного ефекту. Складний характер зв'язування гемоглобіну з киснем відображає крива насичення гемоглобіну O 2. має S-подібну форму (рисунок 3.1).
Підвищення змісту СО 2. Н +. ДФГ на тлі низького парціального тиску O 2 в тканинах сприяє взаємодії цих факторів з гемоглобіном і переходу R-конформації в Т-конформацію. Це призводить до зміщення рівноваги в рівнянні (1) вправо. Що виділився O 2 надходить в тканини.
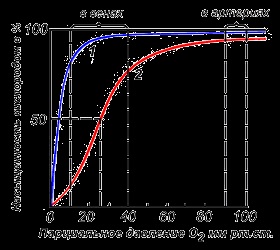
Малюнок 3.1. Криві насичення міоглобіну (1) і гемоглобіну (2) киснем.
3.5.1. Завдання.
1. У гідролізаті складного білка виявлена фосфорна кислота. Чи можна з достатньою впевненістю сказати, до якого класу належить досліджуваний білок?
2. Порівняйте розчинність простетичної групи гемоглобіну в воді і органічних розчинниках.
3.5.2. Еталони рішення.
1. Як видно з таблиці 3.1, фосфорна кислота є простетичної групою білків класу фосфопротеинов. Відомо також, що фосфат входить до складу нуклеїнових кислот, які можуть виступати в якості простетичної групи нуклеопротеїнів. Тому фосфорна кислота може бути виявлена в гідролізаті як Фосфопротеіни, так і нуклеопротеина. Для уточнення класу гидролизованного білка потрібно провести з гидролизатом якісні реакції на азотисті основи і пентози (див. 3.1.).
2. Розчинність речовини у воді або органічних розчинниках залежить від того, які функціональні групи переважають в молекулі. Простетичної група гемоглобіну - гем - містить тільки дві полярні угруповання (дві карбоксильні групи), інша частина молекули неполярна (рівномірний розподіл електронної щільності). Тому гем добре розчиняється в органічних розчинниках і не розчиняється у воді (див. 3.2.).
3. 2, 3-дифосфоглицерата (ДФГ) є аллостерическим регулятором, що знижує спорідненість гемоглобіну до кисню. Тому при збільшенні вмісту ДФГ в еритроцитах рівновагу в рівнянні дисоціації HbO 2 зміщується вправо. Збільшення віддачі кисню оксигемоглобіном має компенсаторне значення для організму, так як заповнює недостатнє надходження кисню з атмосфери (див. 3.2.).