Завдання 1.
Розчин, що містить 34 г суміші гідроксиду калію і гідроксиду натрію нейтралізували надлишком соляної кислоти. В результаті утворилося 47,9 г солей. Визначте масу кожного з гідроксидів у вихідній суміші.
дано:
маса суміші гідроксидів в вихідному розчині: m (КОН + NаОН) = 34 г;
маса солей після нейтралізації розчину: mсмесі солей = 47,9 м
знайти:
масу гідроксиду калію у вихідній суміші: m (КОН) =?
масу гідроксиду натрію в вихідної суміші: m (NаОН) =?
Рішення:
Обидва компоненти суміші (КОН і NаОН) одночасно взаємодіють з соляною кислотою. Записуємо для кожного з речовин суміші свою хімічну реакцію:
КОН + НС1 = КС1 + Н2 Про
NаОН + НС1 = NаС1 + Н2 Про
Вирішити це завдання можна, застосувавши зустрічний алгоритм. Його можна представити таким чином:
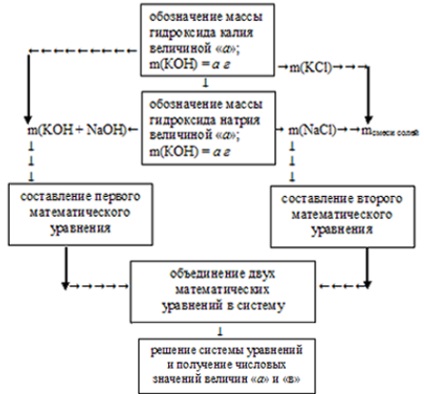
В умови потрібно визначити масу кожної з гідроксидів, тому позначимо масу КОН величиною «а» і масу NаОН величиною «в».
1. Використовуючи введені значення, склав перший математичне рівняння. Для цього прирівняємо суму мас гідроксидів до загальної їх маси в вихідному розчині:
а + b = m (КОН + NаОН) = 34 г,
а + b = 34.
Вийшло одне математичне рівняння з двома невідомими.
2. Тепер, використовуючи величини «а» і «в» як відомі, по рівняннях реакцій нейтралізації визначаємо маси отриманих солей:
Складаємо пропорцію:
а г КОН дають x г КСl (за умовою)
56 г КОН дають 74,5 г КС1 (за рівнянням)
Складаємо пропорцію:
в г NаОН дають х г NаС1 (за умовою)
40 г NаОН дають 58,5 г NаС1 (за рівнянням)
3. З умови відомо, що сумарна маса отриманих солей становить 47,9 м Використовуючи отримані в попередньому дії значення, складають другу математичне рівняння з двома невідомими:
4. Об'єднуємо два математичних рівняння в систему:
Вирішення цієї системи рівнянь дає значення:
а = 13,4 г; в = 20,6 м
Величиною «а» ми позначали масу КОН, отже:
величиною «в» ми позначали масу NаОН, отже:
Відповідь: m (КОН) = 13,4 г; m (NаОН) = 20,6 м
Завдання 2.
92 г суміші карбонату кальцію і безводного нітрату кальцію прожарили до закінчення виділення газів. В результаті виділилася суміш газів з відносною густиною за воднем 21,63. Визначте масу кожної солі в вихідної суміші.
дано:
маса суміші солей: mісход. cмеси [СаСО3) + Са (NО3) 2] = 92 г;
відносна щільність суміші газів за воднем: D (Н2) = 21,63.
знайти:
масу карбонату кальцію в вихідної суміші: m (СаСО3) =?
масу нітрату кальцію в вихідної суміші: m [Са (NО3) 2] =?
Рішення:
Запишемо реакції розкладання кожної з солей:
Для вирішення доведеться використовувати зустрічний алгоритм:
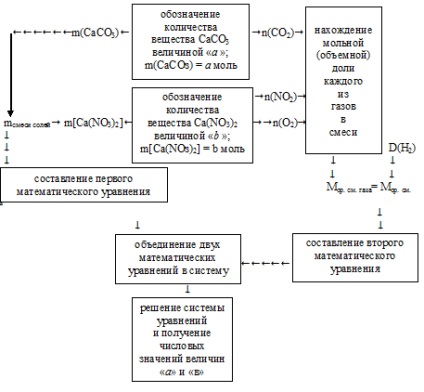
Застосуємо представлений алгоритм.
1. Шуканими величинами є маси солей у вихідній суміші. Для більшої зручності подальших розрахунків розумніше величиною «а» позначати кількість речовини (n, моль) карбонату кальцію: n (СаСО3) = а моль.
Величиною «b» позначимо кількість речовини (n, моль) нітрату кальцію: n [Са (NO3) 2] = b моль.
Відповідно, через молярні маси цих солей можна перейти до мас самих солей:
2. Загальна маса вихідних солей вказана в умові. Це дозволяє скласти перше математичне рівняння з двома невідомими:
3. Далі, використовуючи введені величини «а» і «в», за рівняннями реакцій розкладання визначаємо кількість речовини кожного з газів:
n = a моль n = x моль
CaCO3 = CaO + CO2 ↑
n = 1 моль n = 1моль
Складемо пропорцію:
а моль СаСО3 дають х моль СО2 (за даними умови)
1 моль СаСО3 дають 1 моль СО2 (за рівнянням)
Складемо пропорції:
b моль Са (NO3) 2 дають х моль NО2 (за даними умови)
2 моль Са (NO3) 2 дають 4 моль NО2 (за рівнянням)
b моль Са (NO3) 2 дають у моль О2 (за даними умови)
2 моль Са (NO3) 2 дають 1 моль О2 (за рівнянням)
4. Визначимо мольну частку кожного з газів в суміші (в частках від одиниці).
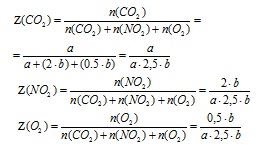
5. Визначимо середню молярну масу суміші газів за значеннями їх мольних часток в суміші.
Згідно із законом Авагадро молярна частка газу в суміші чисельно дорівнює об'ємній частці (тільки для газів), тому в формулу для визначення Мcредн. замість об'ємної частки (Z) підставляємо
значення мольной частки () відповідного газу.
6. Визначимо середню молярну масу суміші газів за даними про відносну щільності.
7. Прирівнюючи один одному вирази Мср. суміші газів отримані в двох попередніх діях, складають другу математичне рівняння:
8. Об'єднуємо рівняння, отримані в другому і сьомому діях в систему
При її вирішенні виходять значення: а = 0,1; b = 0,5.
Величинами «а» і «b» ми позначали кількість речовини СаСО3 і Са (NO3) 2 в вихідної суміші солей, отже:
9. Визначаємо маси солей у вихідній суміші:
- Ви тут:
- Головна
- завдання
- ЄДІ-хімія
- Селективне розділення сумішей | завдання 1