Емульгатори є обов'язковими компонентами косметичних кремів емульсійного типу. Вони в значній мірі визначають якість кремів - їх стабільність, консистенцію, однорідність структури і ін. За останні роки роль емульгаторів при створенні кремів ще більше зросла у зв'язку із застосуванням в їх рецептурі нових біологічно активних речовин і спеціальних добавок, які суттєво впливають на властивості емульсій , в тому числі на їх стійкість.
Часто застосовуються емульгуючі суміші, вони складаються з декількох емульгаторів, містять структурообразующие речовини. За ефективністю вони найчастіше перевершують окремі емульгатори.
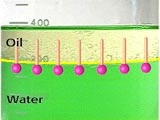
Емульсією називають дисперсионную систему, що складається з двох або більше рідких фаз, одна з яких (що має назву дисперсійнаСереда) є безперервною.
Якщо взяти приблизно однакову кількість масла і води і механічним шляхом, наприклад, при перемішуванні, приготувати емульсію, то після цього відбудеться швидке розшарування. Дрібні краплі емульгованої рідини будуть зливатися в більш великі - тобто система прагне зменшити вільну енергію за рахунок зменшення поверхні розділу фаз. Ще в 1898 р Доннан вказав, що стійкість емульсій повинна залежати від величини міжфазного натягу.
Емульгування - процес утворення стійкої (стабілізованою) емульсії, здатної зберігатися в часі, не руйнуючись.
Емульгуюча здатність - здатність розчинів речовин (зазвичай ПАР) утворювати стійкі емульсії.
Все емульсії діляться на два основних типи: «прямі» масло в воді (М / В), дисперсионной фазою яких виступає вода і «зворотні» вода в маслі (В / М), де дисперсійна фаза, відповідно - масло.
Внаслідок наявності надлишкової запасу вільної поверхневої енергії на межі поділу фаз емульсії являють собою термодинамічно нестійкі системи. Концентровані емульсії з двох чистих рідин розшаровуються незабаром після припинення збовтування в результаті відбувається коалесценції (злиття) крапельок. Тому для отримання стійкої концентрованої емульсії необхідно додавання спеціального емульгатора. який перешкоджав би злиття крапель диспергує рідини. Емульгатори, адсорбируясь на кордоні фаз, знижують поверхневий натяг, а головне, огортаючи крапельки діспергіруемого речовини, утворюють захисну плівку. Остання, володіючи певною механічною міцністю, перешкоджає утворенню великих часток і злиття крапельок в суцільний шар і повідомляє емульсії стійкість.
Розбавлені емульсії з двох чистих рідин характеризуються дещо більшою стійкістю. Додавання стабілізатора при їх отриманні потрібно не у всіх випадках і в меншій кількості в порівнянні з концентрованими емульсіями. Сильно розбавлені емульсії (при концентрації дисперсної фази до 0,1%), в яких імовірність зіткнення крапельок дисперсної фази невелика, зазвичай стійкі і без стабілізатора.
Речовини, що служать емульгаторами, як правило, є органічними сполуками порівняно великого молекулярного ваги. Це переважно розчинні поверхнево-активні речовини, що володіють властивістю знижувати поверхневий натяг на межі обох фаз емульсії.
Як емульгатори в косметиці використовуються:
- різні ПАР (поверхнево-активні речовини)
- натуральні емульгатори рослинного і тваринного походження;
Будова емульгатора.
Молекули емульгатора мають дифільної хімічну структуру. Одна частина молекули має гідрофільні полярні групи (ОН), а інша - неполярні довголанцюгові ліпофільні радикали (вуглеводнева ланцюг, наприклад, Cn-Hm). Залежно від переважання в молекулі тієї чи іншої її частини, речовина буде розчинятися в полярному (вода) або неполярному (масло) розчиннику. У загальному випадку міжфазовий шар складається з одного ряду молекул, звернених своєї полярної частиною до води, неполярной ж - до маслу.
Здатність до утворення емульсій у різних поверхнево-активних речовин різна. Важливу роль має така характеристика емульгатора, як гідрофільно-ліпофільний баланс (ГЛБ). показує баланс між дією полярної і неполярний частин молекул і відображає здатність речовин до утворення емульсій. Ця характеристика дозволяє заздалегідь передбачити тип одержуваної емульсії, але не характеризує її стійкість, так як одного значення ГЛБ може відповідати різну будову молекул ПАР, особливо неіоногенних.
Якщо гідрофільно-ліпофільний баланс емульгатора зрушать убік гидрофильности, отримують пряму емульсію (М / В) і навпаки, незалежно від природи емульгатора.
Таким чином, для отримання прямої емульсії (масло в воді) потрібен гідрофільний емульгатор (ГЛБ прімблізітельно від 8 до 15). а зворотної - ліпофільний (ГЛБ приблизно від 3 до 8).
Найбільш високий показник ГЛБ 40 має лауретсульфат натрію (основний аніонний ПАР для мийних засобів), найнижчий ГЛБ 0 мають неполярні вуглеводні.
Люди давно використовують поверхнево-активні речовини в повсякденному житті. Одними з широко відомих ПАР природного походження є жирні кислоти і натрієві (калієві) солі жирних кислот - мила. До природних ПАР також відносяться ліпіди і жирні спирти.
Освіта міцел.
Важливою властивістю ПАР є здатність до міцелоутворення в їх водних розчинах. При цьому, в залежності від концентрації, його властивості змінюються. Так, в сильно-розведених розчинах не спостерігається спеціальних змін. При збільшенні концентрації єдиний мономолекулярний шар вибудовується на поверхні, і поверхневий натяг знижується до мінімуму. Подальше збільшення концентрації викликає міцелоутворення.
Всі емульгатори, незалежно від їх хімічної природи, по здатності до електролітичноїдисоціації зазвичай поділяють на чотири групи:
- іоногенні (аніонактивні, катіонактівних),
- неіоногенні і
- амфотерні.
Іоногенні емульгатори являють собою: аніонні або катіонні ПАР. Перші, діссоцііруя в воді, утворюють негативно заряджені, другі - позитивно заряджені іони. Типові емульгатори цих груп - мила (аніонні ПАР) і четирехзамещенние підстави (катіонні ПАР)
До аніонактивної відносять хімічні сполуки з аніоном у вигляді радикала з довгою алкильной ланцюгом, що обумовлює поверхневу активність сполуки. Прикладами таких поверхнево-активних речовин є звичайні мила, сульфовані спирти, натрію лаурилсульфат, емульгатор №1.
До катіонактівних поверхнево-активних речовин зараховують солі четвертинних амонієвих підстав, алкіламінів, циклічних амінів і т.д. Поверхнева активність сполук цієї підгрупа обумовлена наявністю катіонів. Катіонактівних ПАР менше знижують поверхневий натяг, ніж аніонактивні, але вони можуть взаємодіяти хімічно з поверхнею адсорбенту, наприклад з клітинними білками бактерій, обумовлюючи бактерицидну дію.
Неіоногенні ПАР - речовини, молекули яких не здатні до дисоціації. Їх дифільні молекули як полярних груп, що обумовлюють їх розчинність, містять зазвичай гідроксильні або ефірні групи.
До неіоногенні поверхнево-активних речовин відносять продукти конденсації окису етилену з різними високомолекулярними жирними кислотами і спиртами, а також ефіри сорбітану, ефіри жирних кислот і сахарози і ін. Неіоногенні ПАР добре поєднуються з ін. ПАР і часто включаються в рецептури миючих засобів.
Для використання в складі косметичних засобів найкращими є і найчастіше ісрользуются неіоногенні емульгатори, які характеризуються більшою біологічною індиферентність, високою стабільністю по відношенню до кислот, електролітів і до зміни pH середовища.
Амфотерні поверхнево-активні речовини представлені головним чином похідними амінокислот і амінофенолов. Поверхнева активність речовини цієї групи залежить від pH, в якій вони перебувають: в кислому - вони катіонактівних, в лужному середовищі - аніонактивної.
Найважливішими представниками поверхнево-активних речовин амфолітнимі групи є фосфатиди рослинного і тваринного походження.
Моно- і дигліцериди стеаринової кислоти - воскоподібні продукти і високов'язкі рідини, що утворюють стабільні емульсії. Жиросахара - складні ефіри сахарози і одноосновних вищих жирних кислот: лауринової, олеїнової, стеаринової. Це тверді безбарвні, позбавлені смаку і запаху речовини, що розм'якшуються при нагріванні до 400 C і перетворюються в легкорухливі рідини при температурі вище 800 С. моноефіри сахарози і лауриновой, стеаринової кислот добре розчинні у воді; повні ефіри розчинні тільки в органічних розчинниках. Жиросахара відрізняються повною фізіологічної індиферентність і хорошими емульгуючими властивостями.
Твіни - це слабоокрашенниє рідини різного ступеня в'язкості, добре розчинні у воді, часто їх називають солюбізатори. Твін-80 навіть дозволений ГФ до застосування в різних лікарських формах як емульгатора, стабілізатора і співрозчинники.
Механізм емульгування. Теорія.
Процес утворення стабільної проти коалесценции емульсії можна визначити як стійке розподіл однієї рідини в іншій у вигляді більш-менш стійких крапельок. Згідно П. А. Ребіндера, а також Л. Я. Кремньову і А. А. Равделю, першою стадією механічного диспергування є розтягування великих крапель диспергованій рідини, причому вони приймають близьку до циліндра (нитки) форму. Друга стадія полягає в тому, що рідкий циліндр при відомих розмірах виявляється нестійким і мимовільно розпадається на крапельки нерівних розмірів (меншу і більшу). Деформації крапель сприяє те, що відбувається також при диспергування і стиснення крапель. У третій стадії частина крапельок коалесцирует при триваючому процесі диспергування в результаті розтягування більших крапель в нестійкі циліндри критичної довжини і їх самовільного розподілу.
При цьому частина дрібних крапельок стабілізується присутнім в системі емульгатором. Межею найбільш високої дисперсності крапельок в концентрованих і висококонцентрованих емульсіях, як це встановлено Л. Я. крем'яних і А. А. Равделем, є крапельки з розміром близько 1 мк.
практичні рекомендації
Емульсії зазвичай готують шляхом енергійного механічного диспергування жирної і водної фази.
Для створення потрібного типу емульсії необхідно перед змішуванням фаз ретельно розчинити емульгатор в майбутньої дисперсійному середовищі. Часто для цього потрібно підігрів обох фаз. В описі до емульгаторів вказується необхідна температура нагріву (зазвичай 50-70С) і рекомендації щодо застосування. Після повного розчинення гідрофільного емульгатора в воді або ліпофільного в маслі, фази змішуються. Для того, щоб процес емульгування стався вдало, температура обох фаз повинна бути однаковою. Важливо також поступове введення внутрішньої фази, яке дозволяє добитися її рівномірного і повного розподілу.
Для тих, хто дочитав до кінця, розповім про те, що емульсії широко поширені в природі! це
- молоко (краплі жиру в воді, стабілізовані сумішами білків, в осн. казеїну, ліпопротеїнів і фосфоліпідів),
- молочний сік рослин, напр. каучуконосов (див. Латекс натуральний),
- нафтові емульсії, деемульгірованіе яких для звільнення від сильно засоленої води є найважливішим завданням первинної переробки нафти.
- Близькі до емульсій кров, а також системи, що містять ліпосоми і мікроорганізми.
- У промисловості і технології емульсії використовують в процесах емульсійної полімеризації, як мастильно-охолоджуючих рідин, у вигляді замінників незбираного молока, як мастила, склади для консервації, проклеюючі склади в произове паперу, апретури для поліпшення св-в і фарбування шкіри, препарати для обробки ниток і тканин.
- Зворотні емульсії служать буровими розчинами при проходці нафтових і газових свердловин, для обробки привибійну зон в них; перспективно використання мікроемульсій для збільшення ступеня нафтовіддачі пластів.
- Різноманітні зворотні емульсії застосовуються у вигляді ліків. і косметичні. мазей і кремів, харчових продуктів (наприклад, маргарин);
-прямі емульсії перфторуглеродних соед. в воді - перспективні кровозамінники.
джерела:
Емульсії, пров. з англ. Л. 1972; Міцелоутворення, Солюбілізація і мікроемульсії, ред. К. мітель, пров. з англ. М. 1980
medicalplanet.su
www.cosmeticsbusiness.com
www.rikenvitamin.jp
www.chemport.ru/
Ажгіхіна І.С. Технологія ліків. 2-е изд. - М. Медицина,
Поверхнево активні речовини. Довідник, під ред. А. А.Абрамзона і Г. M. Пайового, Л. 1979;
Міцелоутворення, солюбілізація і мікроемульсії, пров. з англ. M. 1980