Термодинамічна система - виділяється (реально чи подумки) для вивчення макроскопічна фізична система. що складається з великого числа частинок і не вимагає для свого опису залучення мікроскопічних характеристик окремих частинок [1]. «Частина Всесвіту, яку ми виділяємо для дослідження» [2]. Одиницею вимірювання кількості частинок в термодинамічній системі зазвичай служить число Авогадро [3] (приблизно 6 х 10 23 частинок на моль речовини), що дає уявлення, про величинах якого порядку йде мова. Обмеження на природу матеріальних частинок, що утворюють термодинамічну систему, не накладаються: це можуть бути атоми. молекули. електрони. іони. фотони і т. д. [4] [5]. Будь-який об'єкт, видимий неозброєним оком або за допомогою оптичних приладів (мікроскопи. Телескопи і т. П.), Можна віднести до термодинамічних систем: «Термодинаміка займається вивченням макроскопічних систем, просторові розміри яких і час існування достатні для проведення нормальних процесів вимірювання» [4 ]. Умовно до макроскопічних систем відносять об'єкти з розмірами від 10 -7 м (100 нм) до 10 12 м [6]. Умовність нижньої межі пов'язана, крім іншого, з тим, що для термодинаміки важливий не розмір об'єкта, а число утворюють його частинок. Куб ідеального газу з ребром 100 нм при нормальних умовах містить близько 27 000 часток (див. Постійна Лошмідта).
Будь-яку частину термодинамічної системи називають підсистемою.
Кожна термодинамічна система має межі. реальні або умовні, що відокремлюють її від навколишнього середовища [9]. Іноді замість навколишнього середовища говорять про термостат [4]. т. е. середовищі з настільки велику теплоємність. що її температура при теплообміні з досліджуваної системою не змінюється [10] [11] [12]. За умовчанням передбачається, що навколишнє середовище досить велика і тому її характеристики не залежать від протікають в даній системі процесів. Крім того, зазвичай мається на увазі, що навколишнє середовище перебуває в стані термодинамічної рівноваги і її характеристики не залежать від часу і просторових координат.
Важливо, що до складу термодинамічної системи включають всі частинки, наявні в виділеної для вивчення області простору. Справа в тому, що в термодинаміки іноді один і той же обсяг розглядають як займаний одночасно двома і більше квазінезавісімимі (слабо взаємодіють один з одним) парціальними підсистемами частинок різної природи (наприклад, газову суміш характеризують парціальними тисками складових її газів [13]; в кристалі виділяють підсистеми фононів і магнонов; систему ядерних спінів парамагнетика характеризують власної парціальної спінової температурою [14]. здатною приймати негативні значення за шкалою Кельвіна [15] [16] [17]). Даний формальний прийом дозволяє вводити для даної підсистеми частинок парціальні характеристики. не обов'язково мають пряме відношення до фізичної системі як єдиного цілого (див. наприклад, Негативна абсолютна температура).
Класифікація термодинамічних систем
За характером взаємодії з навколишнім середовищем розрізняють системи [9]:
- ізольовані. не обмінюється з зовнішнім середовищем ні енергією, ні речовиною;
- адиабатически ізольовані. не обмінюється з зовнішнім середовищем речовиною, але допускають обмін енергією у вигляді роботи [18];
- закриті. обмінюються із зовнішнім середовищем енергією, але не обмінюються речовиною;
- відкриті. обмінюються із зовнішнім середовищем і енергією, і речовиною;
- частково відкриті. обмінюються із зовнішнім середовищем і енергією, і речовиною, але у яких не всі складові речовини беруть участь в матеріальному обміні (наприклад, через наявність напівпроникних перегородок) [19].;
За використовуваним для термодинамічного опису системи параметрам стану розрізняють: прості системи. прості відкриті системи і складні системи.
- Простий системою (простим тілом [20]. Термодеформаційних система [21]) називається така рівноважна система, фізичний стан якої цілком визначається значеннями двох незалежних змінних - функцій стану простого тіла (x. Y). наприклад, значеннями температури і питомої обсягу (t. v) або тиску і питомої обсягу (P. v). Вираз залежності трьох характеристик стану простого тіла (x. Y. Z). є попарно незалежними, називається рівнянням стану цього тіла:
Простими тілами є ізотропні тіла (isos- рівний, tropos - напрямок, в цілому - рівність характеристик стану і фізичних властивостей тіла у всіх його точках і у всіх напрямках), зокрема: гази, пари, рідини і багато тверді тіла, що знаходяться в термодинамічній рівновазі і не схильні до дії поверхневого натягу, гравітаційних і електромагнітних сил і хімічних перетворень. Дослідження простих тел в термодинаміки представляють найбільший теоретичний і практичний інтерес.
Якщо що входять до складу системи речовини в даному діапазоні умов (тиск. Температура) хімічно не взаємодіють між собою, то систему називають фізичної. Якщо ж речовини системи реагують один з одним, то говорять про хімічну системі [24] [25] [26].
Реальну ізоляцію термодинамічної системи від навколишнього середовища здійснюють за допомогою стінок (поверхонь розділу. Перегородок. Оболонок) [27]. рухомих і нерухомих, проникних і непроникних для речовини (існують і напівпроникні перегородки). Посудина Дьюара є гарним прикладом адіабатичній оболонки. Перегородка, що не перешкоджає обміну енергією, називається діатермічної.
Термодинамічну систему називають гомогенною. якщо її властивості безперервно змінюється від точки до точки [28]. Гомогенну систему з однаковими властивостями в будь-якій точці називають однорідною [28]. Прикладами гомогенних систем служать розчини (газові, рідкі та тверді). Газова фаза великої протяжності вздовж градієнта поля тяжіння (наприклад, земна атмосфера в безхмарний і безвітряний день) - приклад неоднорідною гомогенної фази (див. Барометрична формула).
Термодинамічну систему називають гетерогенної. якщо вона складається з декількох гомогенних частин з різними властивостями. На поверхнях, які поділяють гомогенні частини гетерогенної системи, властивості системи змінюються стрибком [29]. Часто (але не завжди) ця поверхня є видимою.
Гомогенну частина гетерогенної системи називають фазою [29]. Менш суворо, але більш наочно фазами називають «гомогенні частини системи, відокремлені від інших частин видимими поверхнями розділу» [8]. Прикладом може служити система «лід - вода - вологе повітря». Гомогенна система містить тільки одну фазу; гетерогенна система складається з двох або більше фаз [30]. Число фаз у гетерогенній системі підпорядковується правилу фаз Гіббса. Одне і те ж речовина в твердому агрегатному стані може мати кілька фаз (ромбічна і моноклінна сірка. Сіра і біла олово і ін.) [29].
На малюнку зображений один з варіантів класифікації термодинамічних систем.
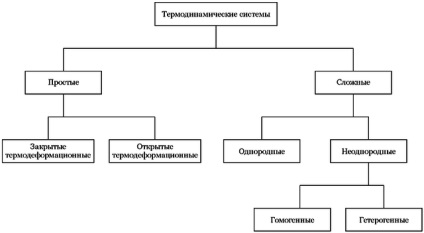
Один з варіантів класифікації термодинамічних систем