Головний спонсор конкурсу - далекоглядна компанія Генотек.
Конкурс підтриманий ВАТ «РВК».
Спонсором номінації «Біоінформатика» є Інститут біоінформатики. Спонсором призу глядацьких симпатій виступила фірма Helicon. Свій приз також вручає Фонд підтримки передових біотехнологій.
Далеко не завжди кращі за результатами комп'ютерного моделювання ( «in silico» [1]) молекули - кандидати в ліки - можуть стати «чудовою таблеткою», наприклад, через їх нерастворимости, стеріческіх (просторових) обмежень на зв'язування з молекулою-мішенню ( зазвичай білком) або захисту випереджаючим патентом. Навіть при виконанні цих умов потенційні ліки може провалити клінічні випробування через проблеми з доставкою до уражених тканин і органів. Воно може дуже швидко руйнуватися і виводитися з організму, так і не досягнувши мети. Крос-реактивність - ще одна проблема при створенні ліків. Вона полягає в тому, що молекули потенційного ліки часто можуть взаємодіяти не тільки з передбачуваної нами мішенню, але і з іншими білками в організмі. В такому випадку побічні ефекти можуть бути навіть більш небезпечні, ніж сама хвороба.
Сучасна технологія ліків та драг-дизайн
Драг-дизайн, або раціональне конструювання ліків, - це активно розвивається останнім часом область досліджень. Основи цього напрямку добре викладені російською мовою в статті Антона Чугунова «Драг-дизайн: як в сучасному світі створюються нові ліки» [2]. Для багатьох хвороб ще немає достатньо ефективних ліків, шлях молекули-кандидата на фармацевтичний ринок займає десятки років, і створення одного ліки варто кілька мільярдів доларів [3]. Бази даних (наприклад, PubChem. ChEMBL. ZINC) містять десятки мільйонів хімічних сполук. Перевірити експериментально, чи є кожна молекула ліками від будь-якої хвороби - практично нездійсненне завдання. Саме тому необхідно проводити первинний відбір в цьому величезному просторі хімічних сполук «in silico». грунтуючись на їх структурах і відомих властивостях. Для цього є багато різних підходів, наприклад, молекулярний докінг [4] і молекулярна динаміка [5]. Молекулярний докинг - метод молекулярного моделювання, який дозволяє передбачати найкраще положення ліганда (зазвичай, малої молекули) щодо білка-мішені, використовуючи їх тривимірні структури і оціночні функції енергії взаємодії молекул. Молекулярна динаміка заснована на використанні рівнянь руху атомів і емпіричних функцій потенційної енергії для розрахунків міжатомних взаємодій і опису еволюції молекулярної системи в часі.
вибір мішеней
Перш, ніж шукати ліки від будь-якої хвороби, потрібно зрозуміти молекулярні основи її розвитку. Вивчити причини і дізнатися, взаємодії між якими білками є ключовими. Таким чином ми можемо описати розвиток захворювання на молекулярному рівні за допомогою каскаду реакцій *. Це необхідно, щоб визначити, які білки є найбільш перспективними мішенями (об'єктами, на які потрібно впливати, щоб виправити або компенсувати порушення, що стали причиною захворювання).
* - До речі, в сучасній системної біології практика записи каскадів реакцій і взагалі ієрархій біохімічних і біологічних процесів набуває все більшого поширення [6]. - Ред.
Що потрібно враховувати при моделюванні, або звідки беруться обхідні стежки
Уявімо, що наші обчислювальні потужності неймовірно великі, і ми можемо перевірити, оцінивши енергію зв'язування, як взаємодіють практично всі відомі малі молекули з білком-мішенню (насправді це далеко не так). Нехай в результаті такої перевірки ми вибрали кілька молекул, які показали найкращі результати. Як ви думаєте, чи всі вони можуть стати ліками? Щоб відповісти на це питання, не проводячи експериментів з клітинами і, тим більше, організмами, нам потрібно провести додаткову перевірку in silico. Давайте згадаємо, що мала молекула повинна задовольняти емпірично отриманого «правилом п'яти» Липинського (мати менше п'яти атомів-донорів водневого зв'язку; володіти молекулярною вагою меншою 500; мати липофильность (log P - коефіцієнт розподілу речовини на межі розділу вода-октанол) менше 5; мати не більше 10 атомів азоту і кисню) [2]. Не можна також забувати і про метаболічні характеристики (ADMET: всмоктування, розподіл, метаболізм, екскрецію, токсичність). Крім усього цього, необхідно, щоб молекула-кандидат була здатна взаємодіяти в просторі з активним центром мішені і задовольняла стеріческім обмеженням. Може бути так, що потенційно активна молекула занадто велика і не може «пробратися» до активного сайту мішені, або вона має складну структуру, через що її дуже важко і дорого синтезувати. Інший варіант: молекула дуже маленька і «універсальна», - тоді вона взаємодіє не тільки з нашої мішенню, але і з багатьма іншими білками в організмі людини. Це призводить до побічних ефектів, які можуть бути дуже серйозними. Картина виходить не самою радісною, а дорога ліки на ринок все більш заплутаною. «З тих пір всі тягнуться переді мною криві, глухі обхідні стежки». - за словами Йосано Акіко, японської поетеси. Добре, що є способи, що допомагають не заплутатися в цих обхідних стежках драг дизайну.
зміна скелета
Коли ви знайшли молекулу-кандидат в ліки, потрібно провести оптимізацію, поліпшити її властивості, щоб збільшити ймовірність успіху при експериментальній перевірці. Розглядаючи молекулу-кандидат (ліганд) ми можемо виділити в ній важливі для взаємодії з білком-мішенню частини, структурну основу - скелет - і інші групи, імовірно які беруть в який нас взаємодії або навіть заважають контакту лиганда з мішенню. Зміна скелета (scaffold hopping) потрібна, коли ми хочемо зберегти важливі для взаємодії з мішенню частини лиганда і замінити інші на більш підходящі. Звичайно ж, необхідно при цьому враховувати зміну енергії зв'язування ліганда з мішенню. Крім цього, змінюються конформаційні властивості лиганда, що позначається на ентропії взаємодії.
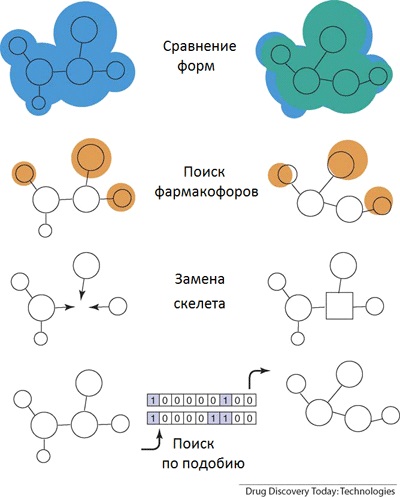
Малюнок 1. Принцип «зміни скелета»: збіг форм, пошук особливих груп, що визначають властивості, сама зміна скелета, пошук за подобою. Картинка з [11].
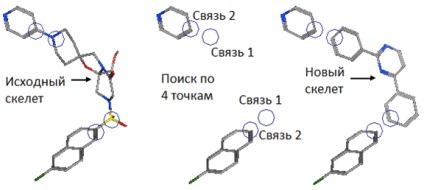
Малюнок 2. Вихідна молекула і молекула - результат зміни скелета. Картинка з [12].
При зміні скелета ми отримуємо багато нових варіантів, серед яких вибираємо кращі, найбільш нам підходять за тривимірну структуру, ентропії, енергії зв'язування з білком-мішенню і іншим характеристикам. Зміна скелета лиганда розширює нам поле можливостей, дає безліч варіацій. Начебто в нас є набір фрагментів конструктора, і ми хочемо зібрати деяку впорядковану і стабільну структуру (використовуючи ці фрагменти і деякі сполучні їх), щоб потім приєднати її до чого-небудь ще. Наче ми втратили один крайній шматочок пазла, але знаємо, що повинно бути в тому місці, яким він приєднується до картини, в результаті чого робить її завершеною. Таким чином, ми можемо, наприклад, з великого і трудносінтезіруемого лиганда зробити маленький, добре здатний пробиратися до сайту зв'язування. Немов вирізати з картону відсутній шматочок пазла, відкинувши все зайве.
Є ще одна цікава область застосування зміни скелета, пов'язана з так званими випереджаючими патентами. Такі патенти видаються на деякий час компаніям, що стверджують про наявність деякої лікарської активності у певній молекули. Протягом цього часу вони повинні довести, що ця активність дійсно є. А що ж робити вам, якщо ви самі знайшли активність у цій молекули і хочете запатентувати її? Коли ви робите зміну скелета, результатом є вже інша молекула, не закрите патентом, але вона володіє цікавить біологічною активністю [7, 9-11].
Пошук схожих молекул з використанням фармакофор
Фармакофор - це набір просторових і електронних ознак, необхідних для забезпечення оптимальних взаємодій з біологічної мішенню, які можуть викликати або блокувати її біологічний відповідь. Такими ознаками можуть бути гидрофобность, ароматичность, донорно-акцепторні властивості, заряд. Ми можемо використовувати пошук по фармакофор при віртуальному (комп'ютерному) скринінгу великих баз даних, бібліотек хімічних сполук. Особливо корисний такий підхід, коли у нас недостатньо інформації про будову мішені і набору лігандів для використання методів моделювання, заснованих на використанні тривимірних структур.
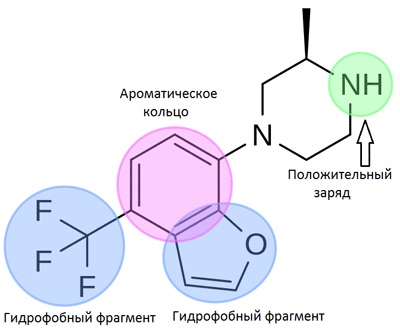
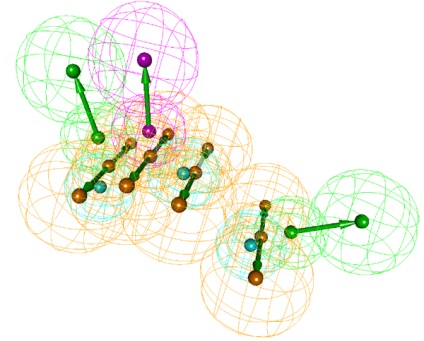
Малюнок 4. Приклад тривимірної фармакофорні моделі. Картинка з вікіпедії.
Малюнок 5. Результати пошуку по молекулярному подобою. Картинка: мануал WODCA.
Пошук по молекулярному подобою
Структурно схожі молекули зазвичай володіють схожими біологічними властивостями. У цьому полягає принцип молекулярного подібності. Нехай ми знаємо, що деякий ліганд активно взаємодіє з мішенню, але в силу різних причин (взаємодія з іншими білками організму і токсичність, порушення властивостей ADMET, захист патентом) не може бути використаний нами в якості нових ліків. Тоді ми можемо здійснити пошук за подобою і знайти підходящу молекулу-ліганд, яка згодом з більшою ймовірністю стане ліками.
Висновок, або що нам вчити, щоб створити ліки?
Прикладом комплексного підходу в драг-дизайні є робота Бергмана з колегами, яка називається «SHOP: scaffold HOPping by GRID-based similarity searches» [16]. У ній використані методи зміни скелета, пошуку за подобою, молекулярного докінгу і деякі математичні обчислення. В якості мішеней для демонстрації методу були взяті тромбін, протеаза ВІЛ-1 та нейрамінідази (білок вірусної мембрани, що володіє ферментативної активністю; один з ключових білків вірусу грипу і хороша мішень для драг дизайну; пошук її інгібіторів почався ще в 1966 році). У створенні ліків велика роль везіння, випадки і ймовірності. Саме тому ми можемо використовувати більш просунуті методи і «обхідні стежки», коли «вгадана» молекула-кандидат не ідеальна. Ми бачимо, що можна її поліпшити, нам хочеться чогось більшого, і ми можемо цього досягти.
«Відкриття - це як закохатися і досягти вершини гори після важкого підйому. »- сказав Макс Фердинанд Перутц, англійський біохімік, лауреат Нобелівської премії 1962 года [8].
Подяки
Петі Власову, що відкрив мені можливості займатися драг дизайном; Наталі Кірєєва, яка читає відмінні лекції по хемоінформатика в МФТІ (ГУ); Феде Кондрашову та Динарі Усманова, які надихають мене займатися наукою.
додаткова література
література
Вас також може зацікавити
З кам'яного віку і до XIX століття чисельність людства залишалася приблизно однаковою, - ситуація, коли у двох батьків доживало до репродуктивного віку двоє дітей. Саме доживало - народжувалося зазвичай з десяток, але більшість гинуло, не залишивши потомства - класика теорії природного відбору. При цьому люди рідко гинули від іклів вовків або тигрів - більшу частину смертей викликали хвороби, перед якими ми були так само беззахисні, як і «брати наші менші». До тих пір, поки не з'явилися вакцини. У цій статті ми не будемо заглиблюватися в теорію імунізації, а замість цього спробуємо відповісти людською мовою на хвилюючі людей питання щодо щеплень.