У Міністерстві сільського господарства Росії пройшло обговорення врегулювання вартості зерна на внутрішньому ринку. Про це йдеться на офіційному сайті відомства.
Обробка земельних ділянок за допомогою гербіцидів для боротьби з борщівник, згідно з попередньою інформацією, буде варто Московському регіону приблизно двадцять три тисячі рублів на кожен гектар. Подібні відомості під час прямого ефіру на «Радіо 1» озвучив глава сільськогосподарського Департаменту Московського регіону Андрій Разін.
Керівник сільськогосподарського Департаменту Московського регіону Андрій Разін став учасником зустрічі співробітників органів виконавчої влади з сільськими трудівниками області. В ході заходу обговорили найважливіші питання, з якими стикається агротехнічний комплекс.
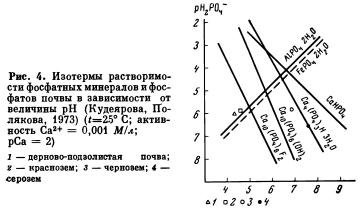
Визначення форм фосфатів грунту по ізотермам розчинності
Форми грунтових фосфатів можуть бути визначені також за допомогою ізотерм розчинності чистих фосфорних сполук. Відомо, що розчинність фосфатів залежить від pH. Використовуючи дані табл. 13, Ліндсей і Морено висловили розчинність чистих фосфорних сполук графічно у вигляді функції рН2РО4 від pH. Для вираження розчинності варисцита, стренгіта і фторапатита робиться припущення, що активності іонів Al3 +, Fe3 + і F- в грунтовому розчині визначаються умовами рівноваги з містяться в твердих фазах гіббсітом, гетитом і флюоритом як найбільш стабільними сполуками в грунтах. При побудові ізотерм розчинності фосфатів кальцію слід враховувати концентрацію кальцію в розчині. Якщо активності іонів визначаються в витяжці 0,01 M CaCl2, то концентрація кальцію буде дорівнює 0,01 M / л (РСА = 2,0). З урахуванням цих припущень рівняння, що використовуються для побудови ізотерм розчинності фосфатів, мають такий вигляд:
Шляхом підстановки різних значень pH в рівняння (38-43) знаходиться величина рН2РO4, яка відкладається по осі ординат, по осі абсцис відкладається величина pH. По декількох точках будуються ізотерми розчинності чистих фосфорних сполук (рис. 4). Використовуючи дані рН2РO4 і pH, певні експериментально в 0,01 MCaCl2 витяжках з ґрунтів, і завдавши їх на діаграму розчинності, можна порівняти розчинність грунтових фосфатів з розчинністю відомих фосфорних сполук. На рис. 4 показано істотна відмінність у формах фосфатів, що містяться в різних типах грунтів. Так, в дерново-підзолисті грунту і червоноземи фосфатне рівновага встановлюється з фосфатами алюмінію типу варисцита, в чорноземі - з фосфатами кальцію, розчинність яких більше, ніж у гидроксилапатита, але менше, ніж у октакальційфосфата. У сіроземах основним фосфорним з'єднанням був октакальційфосфат.
Ізотерми розчинності різних фосфорних сполук можна виразити також у вигляді функції РР від pH; для з'єднань фосфатів кальцію - за допомогою відносини фосфатного і вапняного потенціалів, для з'єднання фосфатів алюмінію і заліза - у вигляді функцій рН2РO4 від 2РН - РА1 або 2РН - pFe відповідно і т. п.
У літературі є дані, що вказують на те, що немає хорошого відповідності між концентрацією фосфору в ґрунтовому розчині і концентрацією, пророкує з значень творів розчинності. Дослідники пояснюють це тим, що існують, наприклад, дві константи рК ін для гидроксилапатита і октакальційфосфата, які відповідають випадку досягнення рівноваги при їх осадженні і при розчиненні.
Подальше ускладнення при встановленні рК ін обумовлено сильним впливом домішок на розчинність різних фосфорних сполук. Так, було показано, що чистий гідроксилапатит підпорядковується правилу твори розчинності, але в присутності невеликих кількостей карбонату кальцію правило порушується. Великий вплив робить також можливе комплексообразование в розчині. Тому невідповідність між концентрацією фосфору в ґрунтовому розчині і рК ін чистих препаратів фосфатів ще не означає, що ці сполуки не визначають концентрацію фосфору в розчині.
Використання констант і ізотерм твори розчинності не дає абсолютних величин вмісту різних форм фосфорних сполук в грунтах, але дає їм якісну оцінку, яка ніколи ступінь їх розчинності і можливі перетворення в різних грунтових умовах.