Газ, в якому горить залізо
Якби повітря не містив азоту, а цілком складався з кисню, життя організмів розвинулася б, звичайно, пристосувавшись до дихання чистим киснем. Одним був би небезпечний такий склад атмосфери: горючістю в ній більшості оточуючих нас предметів.
Страшні і зараз пожежі в селах і містах з переважанням дерев'яних будівель, але у багато разів більше була б небезпека, якби повітря не перебував на 4/5 з азоту, який не підтримує горіння. У ньому тоді горіли б не тільки вугілля і дерево, але і більшість металів. Згоріли б просто не одні дерев'яні хати і будинки, а й залізні мости, і рейки, і гігантські морські судна.
Щоб показати приклади горючості в чистому кисні речовин, що не горять або тільки тліючих в повітрі, добудемо трохи цього газу.
Мал. 24. Різання металу автогеном
Отримують кисень і інакше. Так, окис барію [16] при нагріванні приєднує до себе кисень, звертаючись в перекис барію, а ця остання при більш сильному прожарюванні знову його виділяє. В останні роки кисень з повітря отримують подібним способом, тільки замість окису барію користуються іншим, більш складним за складом речовиною.
У підручниках хімії зазвичай вказують на отримання кисню розкладанням окису ртуті або суміші хлорноватокаліевой солі (бертолетової) і перекису марганцю (пиролюзита). Перший спосіб придатний для отримання дуже незначних кількостей газу, другий не безпечний, і обидва вимагають сильного нагрівання.
Найкраще ілюструвати небезпека бертолетової солі, цього невинного ліки для полоскання горла [17]. такою картинкою:
"Випадок виділення найбільшої кількості кисню, яке тільки нам відомо, стався 12 травня 1899 року на хімічному заводі в Сент-Геленс завдяки тому, що бертолетова сіль випадково занадто нагрілася. Близько 150 тонн приготовленої солі, упакованої в бочках, перебували на складі в очікуванні відправки. Якимось чином іскра від бочки, яку вкочували в приміщення, де кристалізується сіль, потрапила в дерев'яну раму кристаллизационного чана. Дерево це, будучи просякнуте бертолетової сіллю, було у високому ступені здатне до займання. І дей ствительно, спалахнув страшний вогонь, який піднявся вгору, і через кілька хвилин дах будівлі була охоплена полум'ям. Тут сталася страшна сцена: неймовірний жар, загострюючи ряд за рядом тісно складені бочки з бертолетової сіллю, викликав виділення величезної кількості чистого кисневого газу, який розходився в всі сторони. всі дерев'яні споруди, занурені таким чином в атмосферу чистого кисню, горіли зі страшною силою, так що незабаром вся будівля розжарений до білого, горя з яскравим блиском, як в плавильної печі. Нарешті, коли кисень не міг уже більше досить швидко виділятися з Боченков, сіль вибухнула.
І що за вибух. Два величезних удару, швидко пішли один за іншим, сповістили місту про те, що трапилося нещастя, а клуби чорного диму, що піднялися в вигляді гігантського стовпа, вказували місце вибуху. Весь завод розлетівся на друзки. Будинки й склади зрівнялися з землею. Великі пересувні підйомні крани згоріли, як сірники. Вершина сусіднього газгольдера [18] була розірвана на шматки, і близько 1/4 мільйона куб. футів палаючого газу злетіло в повітря. Летючі і палаючі головешки поширювали пожежа, який представляв вражаюче видовище величезного стовпа полум'я, зі страшним ревом піднімається на 500-600 футів у висоту. Удар був настільки страшний, що земля захиталася, як при землетрусі. Будинки були знесені, як вітром; на цілі милі всі стекла були розбиті вщент гігантської повітряної хвилею, тоді як весь місто було охоплене панікою. Пасажири поїзда, який тільки що підійшов до станції, зазнали страшне випробування: хоча станція перебувала далеко від місця вибуху, вагони підстрибнули на місці, і всі стекла були розбиті наче кимось навмисне і відразу.
Ймовірно, близько півтора мільйона куб. футів кисневого газу таким чином відразу вилилося в повітря. Ця катастрофа була простим повторенням, тільки у великих обсягах, одного з пригод, які відбуваються з кожним, хто початківцям практично вивчати хімію, саме при приготуванні кисню нагріванням бертолетової солі "[19].
Чи не правда, краще кисень добувати як-небудь інакше, безпечніше? Так!
І я раджу отримати його дією марганцево-кислого калію на перекис водню.
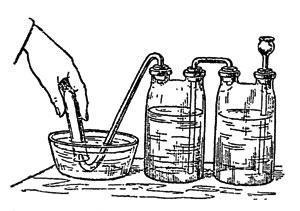
Мал. 25. Добування кисню
Те й інше легко дістати в будь-якій аптеці. Міцний розчин перекису водню влийте в колбу з лійкою або двугорлую склянку, всипте туди ж марганцево-кислого калію і збирайте виділяється кисень в циліндри або пляшки, наповнені водою і перекинуті отвором вниз, в пневматичну ванну (рис. 25), - словом, так, як збирали водень. Тільки, виймаючи з ванни судини з газом, ставте їх отвором вгору, прикриваючи матовою скляною пластинкою, тому що кисень трохи важчий за повітря.
палаюче залізо
Обернувши навколо олівця тонку відпалений залізний дріт, насаджують на її кінець шматочок пробки, запалюють останню і опускають дріт в посудину з киснем. Можна прямо вколоти вільний кінець дроту в м'яку пробку і закрити нею склянку з газом. На дні склянки треба залишити трохи води, тобто, збираючи в неї виділяється кисень, не витісняти їм з посудини всю воду. В цьому випадку окалина (продукти горіння заліза), що виходить при згорянні заліза, остигає в воді, а інакше дно склянки може лопнути (рис. 26).
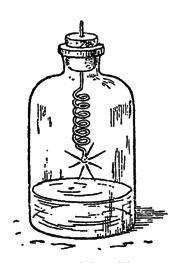
Мал. 26. Горіння заліза в кисні
Наберіть кисню в бутель з темно-зеленого скла і запаліть в ньому стрічку магнію (через біле скло світло буде такий яскравий, що може зашкодити очам).
Влийте в посудину води, гарненько збовтайте з утворився порошком окису магнію і через деякий час спробуйте, як кажуть хіміки, реакцію рідини. Незважаючи на незначну розчинність окису магнію в воді (з утворенням гідрату окису), реакція буде слабощелочная. Лакмусовий папірець стане синюватого кольору. Це показує, до чого трохи лакмус до кислот і лугів, так як одна вагова частина окису магнію розчиняється тільки в 55.000 частин води.
Помилка Жюля Верна
У романі Жюля Верна "Таємничий острів" є такі рядки: "Потім руда і вугілля були розміщені шарами, що чергуються - шар руди на шарі вугілля і т. Д. Тепер, після того як вугілля буде запалено і в купу стануть нагнітати повітря хутром, в ній повинні відбутися наступні хімічні процеси: під впливом рясного припливу кисню повітря вугілля, згораючи, перетворюється на вуглекислоту. Вуглекислота ж, впливаючи на руду окису заліза, забирає від неї частинку кисню і таким чином виділяє з неї чисте залізо ".
Помилився на цей раз Жюль-Верн!
Вуглекислота, правильніше - вугільний ангідрид - граничне з'єднання вуглецю з киснем. Воно від окису заліза відняти кисень не може. Насправді при неповному згорянні вуглецю утворюється окис вуглецю, яка і забирає від руди кисень, перетворюючись в вугільний ангідрид.
Виділяється залізо не чисто, воно містить домішка вуглецю.
Живі мерці
Набагато легше забарвиться лакмусовий папір у синій колір, якщо повторити останній досвід, замінивши магній калієм або натрієм. Це дуже легкі (легше води) серебрістобелимі в свіжому розрізі, м'які як віск метали, які, подібно кальцію, доводиться зберігати в гасі. Вони також виділяють з води водень, але ця реакція йде у них ще енергійніше, супроводжуючись таким нагріванням, що виділяється газ загоряється, а з ним разом починають горіти і самі метали. Ми не станемо проробляти цей досвід і вам не порекомендуємо, - він часто супроводжується невеликим вибухом, який небезпечний тим, що їдка рідина може бризнути в очі і заподіяти непоправне лихо. Я зараз хочу показати інший досвід.
Обережно, не торкаючись натрію руками, вийнявши його пінцетом з баночки, відділяю ножем шматочок величиною в дрібну горошину, видаляю з нього гас пропускної папером, кладу метал в залізну ложечку, нагріваючи в полум'я спиртової лампочки.