До складу зареєстрованого ЛЗ увійшли софосбувір. велпатасвір і нове з'єднання - воксілапревір. Воксілапревір є інгібітором протеази 3 / 4A. У відомстві розповіли, що Восеві став першим препаратом, схваленим для лікування пацієнтів, які раніше пройшли терапію софосбувір або іншими протівогепатітнимі ЛЗ, які інгібують NS5A.
Комбінований препарат передбачає використання один раз на добу, кожна таблетка містить 400 мг софосбувір, 100 мг велпатасвіра і 100 мг воксілапревіра. Gilead встановив ціну на Vosevi в розмірі 24 920 доларів за упаковку 28 таблеток, вирівнявши її з Epclusa, таблетка якого містить 400 мг софосбувір, 100 мг велпатасвіра (74 760 долларов за 12-тижневий курс), тобто фактично Gilead надає третій компонент Vosevi безкоштовно. Комбінація схвалена для повторної терапії вірусного гепатиту С (ВГС) при передувала невдачі терапії всіх генотипів режимами на базі інгібіторів NS5A, а також при невдачі терапії генотипу 1a або 3, де раніше застосовувався режим на базі сфосбуваіра без інгібіторів NS5A.
У ключових клінічних дослідженнях III фази серії POLARIS оцінювалася ефективність і безпеку 12 тижнів терапії Vosevi у пацієнтів без цирозу або з компенсованим цирозом печінки, які раніше отримували препарати прямої дії.
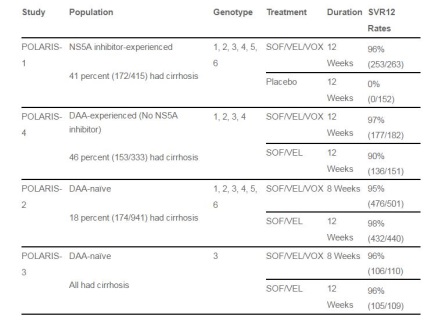
Дослідження POLARIS-1 продемонструвало ефективність 12-тижневої терапії Vosevi у 96,2% (досягнення стійкої вірусологічної відповіді через 12 тижнів після закінчення терапії, SVR12) у пацієнтів (n = 263), раніше получавіх режими на базі інгібіторів NS5A. Кожен шостий пацієнт в даному дослідженні мав значущі мутації лікарської стійкості.
У дослідженні POLARIS-4 потрійна комбінація Vosevi (n = 181) порівнювалася з терапією софосбувір і велпатасвіром (n = 151) у пацієнтів з цирозом і без цирозу, які раніше отримували режими на базі софосбувір без використання інгібіторів NS5A або NS3, також виключалися пацієнти, які отримували класичну інтерферонову терапію з рибавірином. Потрійний режим забезпечив SVR12 в 98% випадків, проти 90% в разі подвійного режиму.
Переносимість Vosevi була на дуже високому рівні, і приблизно відповідала переносимості в групі плацебо. Найбільш часто спостерігалися головний біль, підвищена стомлюваність, діарея і нудота.
Раніше FDA схвалила застосування комбінації софосбувір + велпатасвір (інгібітор РНК-полімерази NS5B). Ефективність та безпечність комбінованого ЛЗ була підтверджена результатами декількох клінічних досліджень III фази, в яких взяли участь пацієнти з гепатитом С і з цирозом печінки (або без нього). Згідно з отриманими результатами, через 12 тижнів терапії новим ЛЗ у 95-99% вірус переставав визначатися в крові.