§ 120. Залізо Fe (побічна підгрупа VIII групи)
Побічна підгрупа VIII групи періодичної системи елементів Д. І. Менделєєва на відміну від інших містить три тріади елементів: залізо Fe, кобальт З, нікель Ni відносять до сімейства заліза, а рутеній Ru, родій Rh, паладій Pd, осмій Os, іридій 1г і платину Pt відносять до сімейства платинових металів, грунтуючись на схожості їх властивостей.
Розглянемо залізо як представника його родини в побічної підгрупи VIII групи. Залізо розташовується в четвертому періоді.
Атомний вагу заліза 55, 84, заряд ядра +26. Розподіл електронів по енергетичним рівням (+26): 2, 8, 14, 2. Електронна конфігурація зовнішнього і предвнешнего шару заліза 3s23p63d64s2.
Таким чином, у атома заліза, крім двох s-електронів четвертого зовнішнього шару, є ще шість d-електронів третього предвнешнего шару. З цих d-електронів найбільш активні 4 неспарених. Отже, в освіті валентних зв'язків заліза особливо активно бере участь 6 електронів - 2 з зовнішнього і 4 з предвнешнего шарів. Найбільш поширеними ступенями окислення заліза є Fe +2 і Fe +3. Залізо - один з найпоширеніших у природі елементів. За поширеністю серед інших елементів воно займає четверте місце.
■ 57. Виходячи з будови атома заліза, а також розподілу електронів по орбіталях, вкажіть можливі ступені окислення цього елемента. (Див. Відповідь)
Залізо у вільному стані являє собою сріблясто-сірий блискучий метал з щільністю 7,87, температурою плавлення +1535 ° і температурою кипіння 2740 °. Залізо має яскраво вираженими феромагнітними властивостями, т. Е. Під впливом магнітного поля намагничивается і при припиненні дії поля зберігає магнітні властивості, саме стаючи магнітом. Такими властивостями володіють всі елементи групи заліза.
За хімічними властивостями залізо є досить активним металом. За відсутності вологи залізо на повітрі не змінюється, але при впливі вологи і кисню повітря піддається сильній корозії і покривається пухкої плівкою іржі, що представляє собою гідроксиду заліза, які не захищають його від подальшого окислення, і залізо поступово окислюється в усій своїй масі:
4Fe + 2Н2О + 3О2 = 2Fe2O3 · 2H2O
Розроблено ряд методів захисту цього найціннішого металу від корозії.
В ряді напруг залізо розташовується лівіше водню. У зв'язку з цим воно легко піддається дії розбавлених кислот, перетворюючись в сіль двовалентного заліза, наприклад:
Fe + 2НСl = FeCl2 + Н2 ↑
З концентрованими сірчаної та азотної кислотами залізо не реагує. Ці кислоти створюють на поверхні металу таку міцну і щільну плівку окису, що метал стає абсолютно пасивним і вже не вступає в інші реакції. У той же час при безпосередній взаємодії з такими сильними окислювачами, як галогени. залізо завжди проявляє ступінь окислення +3:
2Fe + 3Сl2 = 2FeCl3
Залізо вступає в реакцію з перегрітою парою; при цьому з води витісняється водень. а розпечене залізо перетворюється в оксид, причому це завжди або закис заліза FeO, або закис-окис заліза Fe3O4 (Fe2O3 · FeO):
Fe + Н2О = FeO + H2 ↑
3Fe + 4H2O = Fe3O4 + 4H2 ↑
Розпечене в чистому кисні залізо енергійно згорає з утворенням залізної окалини (див. Рис. 40).
3Fe + 2O2 = Fe3O4
При прожаренні залізо утворює з вуглецем сплав і одночасно карбід заліза Fe3C.
■ 58. Перерахуйте фізичні властивості заліза.
59. Які хімічні властивості заліза? Дайте обґрунтовану відповідь. (Див. Відповідь)
§ 121. З'єднання заліза
Залізо утворює два ряди сполук - з'єднання Fe +2 і Fe +3. Для заліза характерні два оксиду - закис FeO і окис Fe2O3. Правда, відомий змішаний оксид Fe3O4, молекула якого представляє собою кисневі сполуки дво- і тривалентного заліза: Fe2O3 · FeO. Цей оксид називається також залізної окалиною, чи закисом-окисом заліза.
З'єднання закісного заліза менш стійкі, ніж окисно-о, і при наявності окислювача, навіть якщо їм є тільки кисень повітря, зазвичай переходять в з'єднання тривалентного заліза. Наприклад, гідроокис заліза (II) Fe (OH) 2 являє собою біле тверда речовина, але в чистому вигляді її можна отримати лише тоді, коли розчини реагентів не містять розчиненого кисню і якщо реакцію вести за відсутності кисню повітря:
FeSO4 + 2NaOH = Fe (OH) 2 + Na2SO4
Сіль, з якої отримують гідроокис заліза (II), звичайно, не повинна містити жодної домішки окисних сполук. Оскільки такі умови створити в звичайній навчальної лабораторії дуже важко, гідроокис заліза (II) виходить у вигляді більш-менш темно-зеленого осаду студенистого виду, що свідчить про те, що відбувається окисленні з'єднань двовалентного заліза в тривалентне. Якщо гідроокис заліза (II) тримати тривалий час на повітрі, то поступово відбувається перетворення її в гідроокис заліза (III) Fe (OH) 3:
4Fe (OH) 2 + О2 + 2Н2O = 4Fe (OH) 3
Гідроксиду заліза є типовими нерозчинними гідроокисами. Гідроокис заліза (II) має основні властивості, а у гідроксиду Fe (OH) 3 вельми слабо виражені амфотерні властивості.
■ 60. Перерахуйте властивості окису заліза як типового основного оксиду. Дайте обґрунтовану відповідь. Всі рівняння реакцій напишіть в повній і скороченій іонних формах. (Див. Відповідь)
61. Перерахуйте властивості гідроксиду заліза (II). Підтвердіть свою відповідь рівняннями реакцій. (Див. Відповідь)
Серед солей заліза (II) найбільше значення має залізний купорос FeSO4 · 7H2O, до складу якого входить 7 молекул кристалізаційної води. Залізний купорос добре розчиняється в воді. Застосовується він для боротьби з шкідниками сільського господарства, а також при виготовленні барвників.
З солей тривалентного заліза найбільше значення має хлорид заліза FeCl3, що представляє собою досить гігроскопічні помаранчеві кристали, які при зберіганні поглинають воду і розпливаються в коричневу кашку.
Солі заліза (II) легко можуть переходити в солі заліза (III), наприклад при нагріванні з азотною кислотою або з перманганатом калію в присутності сірчаної кислоти:
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2 (SO4) 3 + 2NO + 4Н2O
Окислення солей Fe +2 в солі Fe +3 може відбуватися і під дією кисню повітря при зберіганні цих з'єднань, але тільки цей процес більш тривалий. Для розпізнавання катіонів Fe 2+ і Fe 3+ служать дуже характерні специфічні реактиви. Наприклад, для розпізнавання двовалентного заліза беруть червону кров'яну сіль K3 [Fe (CN) 6], яка при наявності іонів двовалентного заліза дає з ними характерний інтенсивний синій осад турнбулевой сини:
3FeSО4 + 2K3 [Fe (CN) 6] = Fe3 [Fe (CN) 6] 2 + 3K2SО4
або в іонному вигляді
3Fe 2+ + 2 [Fe (CN) 6] 3 = Fe3 [Fe (CN) 6] 2
Для розпізнавання солей Fe3 + застосовують реакцію з жовтою кров'яною сіллю K4 [Fe (CN) 6]:
4FeCl3 + 3K4 [Fe (CN) 6] = Fe4 [Fe (CN) 6] 3 + 12KCl
4Fe 3+ + 3 [Fe (CN) 6] 4 = Fe4 [Fe (CN) 6] 3
При цьому випадає інтенсивного синього кольору осад берлінської блакиті. Берлінська лазур і турнбулевої синь використовуються як барвники.
Крім того, тривалентне залізо можна розпізнавати за допомогою розчинних солей - роданида калію KCNS або роданида амонію NH4CNS. При взаємодії цих речовин з солями Fe (III) розчин набуває криваво-червоне забарвлення.
■ 62. Перерахуйте властивості солей Fe +3 і Fe +2. Яка ступінь окислення є більш стійкою?
63. Як здійснити перетворення солі Fe +2 в сіль Fe +3 і навпаки? Наведіть приклади. (Див. Відповідь)
Реакція йде за рівнянням:
FeCl3 + 3KCNS = Fe (CNS) 3 + 3КСl
або в іонному вигляді
Fe 3+ + 3CNS - = Fe (CNS),
З'єднання заліза відіграють велику роль в житті організмів. Наприклад, воно входить до складу головного білка крові - гемоглобіну, а також зеленої речовини рослин - хлорофілу. Залізо надходить в організм головним чином у складі органічних речовин харчових продуктів. Багато заліза містять яблука, яйця, шпинат, буряк. Як лікарські препарати залізо застосовується у вигляді солей органічних кислот. Хлорид заліза служить кровоспинну засобом.
■ 64. У трьох пробірках знаходяться: а) сульфат заліза (II), б) сульфат заліза (III) і в) хлорид заліза (III). Як визначити, в якій пробірці яка сіль?
65. Як здійснити ряд перетворень:
Fe → FeCl2 → FeSO4 → Fe2 (SO4) 3 → Fe (OH) 3 → Fe2O3.
66. Дано такі речовини. залізо, соляна кислота. хлор. їдкий натр. Як, користуючись тільки цими речовинами, отримати гідроокис заліза (II) і гідроксид заліза (III)?
67. Розчин, що містить хлорид хрому (III) і хлорид заліза (III), обробили надлишком лугу. Отриманий осад відфільтрували. Що залишилося на фільтрі і що перейшло в фільтрат? Дайте обґрунтовану відповідь за допомогою рівнянь реакцій в молекулярній, повної іонної і скороченою іонної формах. (Див. Відповідь)
§ 122. Сплави заліза
Залізо є основою чорної металургії, тому його видобувають у величезних кількостях. Нова програма розгорнутого будівництва комунізму передбачає в 1980 р виробництво 250 млн. Т стали. Це в 3,8 рази більше, ніж в 1960 р
Залізо майже ніколи не застосовується в чистому вигляді, а тільки у вигляді сплавів. Найважливішими сплавами заліза є його сплави з вуглецем - різні чавуни і стали. Основна відмінність чавуну від стали в змісті вуглецю: в чавуні міститься більше 1,7% вуглецю, а в сталі - менше 1,7%.
Велике практичне значення мають феросплави (сплав заліза з кремнієм), ферохром (сплав заліза з хромом), феромарганець (сплав заліза з марганцем). Феросплави - це чавуни, що містять більше 10% заліза і не менше 10% відповідного компонента. Крім того, в них є ті ж самі елементи, що і в чавуні. Феросплави застосовуються в основному при «раскислении» стали і як легуючі домішки.
Серед чавунів розрізняють лінійні і переробні. Ливарний чавун використовується для виливків різних деталей, переробний-переплавляється на сталь, оскільки володіє дуже високою твердістю і не піддається обробці. Переробний чавун білого кольору, а ливарний - сірого. Переробний чавун містить більше марганцю.
Стали бувають вуглецеві і леговані. Вуглецеві сталі зазвичай являють собою сплав заліза з вуглецем, а леговані містять легуючі добавки, т. Е. Домішки інших металів, які надають стали більш цінні властивості. Ванадій надає стали гнучкість, пружність, стійкість при загартуванню, вольфрам і молібден - твердість і жароміцність. Стали з добавками цирконію дуже пружні і пластичні; їх використовують для виготовлення броньових плит. Домішки марганцю роблять сталь стійкою до удару і тертя. Бор підвищує ріжучі властивості стали при виготовленні інструментальних сталей.
Іноді навіть незначні домішки рідкісних металів надають стали нові властивості. Якщо витримати сталеву деталь в порошку берилію при температурі 900-1000 °, то твердість сталі, її зносостійкість сильно підвищуються.
Хромонікелеві або, як їх ще називають, нержавіючі, стали стійкі до корозії. Сильно шкодять стали домішки сірки і фосфору - вони роблять метал крихким.
■ 68. Які найважливіші сплави заліза вам відомі? (Див. Відповідь)
69. У чому полягає головна відмінність стали від чавуну?
70. Які властивості чавуну і які види чавуну ви знаєте?
71. Що таке леговані стали ілегуючі добавки? (Див. Відповідь)
§ 123. Доменний процес
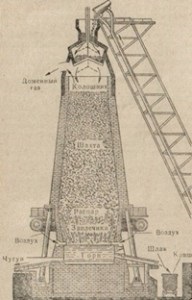
Мал. 83. Схема пристрою доменної печі.
потрапляє в довгу шахту печі, розширюється донизу, що полегшує пересування завантажується зверху вниз. У міру пересування шихти до найбільш широкої частини печі - розпарити - з нею відбувається ряд перетворень, в результаті яких утворюється чавун, що стікає в горн - найбільш гарячу частину печі. Тут же збирається шлак. Чавун і шлак випускають з печі через спеціальні отвори в горні, звані вічками. Через верхню частину горна в домну вдувають повітря, що підтримує горіння палива в печі.
Розглянемо хімічні процеси, що протікають при виплавці чавуну. Шихта доменної печі, т. Е. Комплекс завантажуються в неї речовин, складається із залізної руди, палива і флюсів, або плавнів. Залізних руд є багато. Головні руди - магнітний залізняк Fe3О4, червоний залізняк Fe2О3, бурий залізняк 2Fe2О8 · 3H2О. У доменному процесі в якості залізної руди застосовується сидерит FeCO3, а іноді пірит FeS2, що перетворюється після випалу в колчеданових печах на залишок Fe2О3, який і може використовуватися в металургії. Така руда менш бажана через велику домішки сірки. Виплавляють в доменній печі не тільки чавун, але і феросплави. Паливо, що завантажується в піч, служить одночасно для підтримки високої температури в печі та для відновлення заліза з руди, а також бере участь в утворенні сплаву з вуглецем. Паливом служить зазвичай кокс.
В процесі виплавки чавуну кокс газифіковане, перетворюючись, як і в газогенераторе, спочатку в двоокис а потім в окис вуглецю:
З + О2 = СО3 СО2 + С = 2СО
Окис вуглецю є хорошим газоподібним відновником. З її допомогою відбувається відновлення залізної руди:
Fe2О3 + 3СО = 3СО2 + 2Fe
Разом з рудою, що містить залізо, в піч обов'язково потрапляють домішки порожньої породи. Вони бувають дуже тугоплавкі і можуть закупорити піч, яка працює безперервно довгі роки. Для того щоб пусту породу було легко витягти з печі, її переводять в легкоплавкое з'єднання, перетворюючи флюсами (плавнями) в шлак. Для перекладу в шлак основний породи, що містить, наприклад, вапняк, який розкладається в печі за рівнянням
СаСО3 = СаО + СО2
додають пісок. Сплавляючись з окисом кальцію, пісок утворює силікат:
СаО + SiO3 = CaSiO3
Ця речовина з незрівнянно більш низькою температурою плавлення. У рідкому стані воно може бути випущено з печі.
Якщо ж порода кисла, яка містить велику кількість двоокису кремнію, то тоді в піч завантажується, навпаки, вапняк, який переводить двоокис кремнію в силікат, і в результаті виходить такий же шлак. Раніше шлак був відходом, а тепер його охолоджують водою і використовують як будівельний матеріал.
Для підтримки горіння палива в домну безперервно подається підігрітий, збагачене киснем повітря. Підігрівається він в спеціальних воздухонагревателях - кіуперах. Каупер - висока вежа, складена з вогнетривкої цегли, куди відводять відходять з домни гарячі гази. Доменні гази містять двоокис вуглецю СО2, азот N2 і окис вуглецю СО. Окис вуглецю згоряє в Каупер, тим самим підвищуючи його температуру. Потім доменні гази автоматично направляються в інший Каупер, а через перший починається продувка повітря, що направляється в домну. В розпеченому Каупер повітря нагрівається, і таким чином економиться паливо, яке у великій кількості витрачалося б на підігрів в домну повітря. Кожна домна має кілька кауперів.
■ 72. Який склад-шихти доменної печі? (Див. Відповідь)
73. Перерахуйте основні хімічні процеси, що протікають при виплавці чавуну.
74. Який склад доменного газу і як він використовується в кауперах?
75. Скільки чавуну, що містить 4% вуглецю, можна отримати з 519, 1 кг магнітного залізняку, що містить 10% домішок?
76. Яка кількість коксу дає обсяг окису вуглецю, достатній для відновлення 320 кг окису заліза, якщо кокс містить 97% чистого вуглецю?
77. Як слід обробити сидерит і пірит. щоб з них можна було отримати залізо? (Див. Відповідь)
§ 124. Виплавка стали
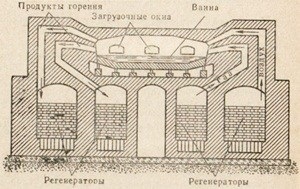
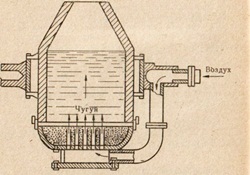
Мал. 85. Схема пристрою конвертора Бессемера
В електропечах (рис. 86) виплавляється легована сталь спеціальних сортів, головним чином з високий і температурою плавлення, що містить кобальт. хром. вольфрам та інші добавки. Готову сталь направляють в прокатку. Там на величезних прокатних станах - блюмінгах і слябінгах - обжимають розпечені сталеві болванки за допомогою валків, що дозволяють виготовляти із сталевого злитка різноманітні форми.
Залізо у вигляді сплавів знаходить широке застосування в народному господарстві. Без нього не обходиться жодна галузь народного господарства. З метою економії чорних металів в даний час в міру можливості намагаються замінювати їх синтетичними матеріалами.
З чорних металів виготовляють верстати і автомобілі, літаки і інструменти, арматуру для залізобетонних конструкцій, жерсть для консервних коробок і покрівельне листове залізо, кораблі і мости, сільськогосподарські машини та балки. труби і цілий ряд побутових виробів.
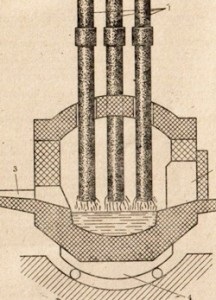
Рис 86. Схема електродугової печі.
1 -електрод, 2 завантажувальний вікно, 3 жолоб для випуску сталі, 4 поворотний механізм