Мети. Ознайомити з положенням заліза в періодичній системі хімічних елементів Д. І. Менделєєва, будовою атома, природними родовищами, сполуками, сучасними методами отримання, властивості і застосуванням заліза. Сприяти виробленню у школярів навичок колективної праці і товариської взаємодопомоги.
Устаткування і реактиви. Пробірки, таблиці по доменному виробництву; розчини HCl і H2 SO4. порошки Fe (OH) 2 і Fe (OH) 3. залізні ошурки, розчини жовтої кров'яної солі K4 [Fe (CN) 6] і червоної кров'яної солі K3 [Fe (CN) 6].
Тип уроку. Елементи лекції, розповідь, бесіда.

- магнетит Fe3 O4- містить 72% заліза, родовища магнетиту зустрічаються на Південному Уралі, Курської магнітної аномалії;

Відновлення ведуть при температурі 850-900 ° С, що нижче температури плавлення заліза (тисяча п'ятсот тридцять дев'ять ° С).
Для багатьох сучасних галузей техніки потрібно залізо дуже високого ступеня чистоти. Тоді очистку технічного заліза проводять карбонільним методом. Карбоніли - це з'єднання металів з оксидом вуглецю (II) СО. Залізо взаємодіє з СО при підвищеному тиску і температурі 100-200 ° С, утворюючи пентакарбоніл заліза:
Пентакарбоніл заліза - рідина, яку легко можна відокремити від домішок перегонкою. При температурі близько 250 ° С карбоніл легко розкладається, утворюючи порошок заліза:
Якщо отриманий порошок піддати спікання в вакуумі, то вийде метал, який містить 99,98-99,999% заліза. Навіщо потрібно отримувати метал такої міри чистоти?
Учень. Залізо високого ступеня чистоти потрібно перш за все для вивчення його властивостей, тобто для наукових цілей. Якби не вдалося отримати чисте залізо, то не впізнали б, що це - м'який, легко обробляти метал. Хімічно чисте залізо набагато більш інертно, ніж залізо технічне. Важливою галуззю використання чистого заліза є виробництво спеціальних феросплавів, властивості яких погіршуються від присутності домішок.
Учитель. Які ж хімічні властивості заліза?
Учень. Хімічні властивості заліза обумовлені будовою електронних оболонок його атомів. Залізо - елемент побічної підгрупи VIII групи 4-го великого періоду. Залізо відноситься до d-елементів, електронна формула атома має закінчення ... 3d 6 4s 2. Залізо в з'єднаннях проявляє ступені окислення +2 і +3. Максимальний ступінь окислення заліза +6. Вона проявляється в Феррата - солях неіснуючої залізної кислоти. Наприклад, Na2 FeО4- феррат натрію.
Учитель. Як реагує залізо з киснем?
Учень. В електрохімічному ряді напруг залізо стоїть лівіше водню, т. Е. Має більш негативний електродний потенціал. Тому залізо легко розчиняється в соляній і розведеної сірчаної кислотах з виділенням водню:
Більш концентровану сірчану кислоту (40-60%) залізо відновлює до
оксиду сірки (IV):
У сірчаної кислоти ще більш високої концентрації (від 80 до 100%) железопассівіруется - покривається тонкою і міцною оксидною плівкою, яка оберігає метал від розчинення. Таке ж явище пасивації спостерігається і в сильно концентрованої азотної кислоти, тому концентровані сірчану і азотну кислоти можна перевозити в залізній тарі.
З розведеною азотною кислотою залізо може реагувати з утворенням солі заліза (II), а з більш концентрованим розчином кислоти - солі заліза (III) і різних продуктів відновлення кислоти, наприклад:
Учитель. Згадайте, що називається корозією. Які її наслідки?
Учень. Корозія - це руйнування металу під дією навколишнього середовища. Освіта іржі можна представити в наступному вигляді:
Іржа відшаровується від поверхні металу, має багато пор, тому не оберігає метал від подальшої корозії. Через корозію гине величезна кількість заліза і його сплавів. У XIX ст. коли не існувало надійних методів боротьби з корозією, від неї гинула половина, що виплавляється. У сучасних умовах від корозії гине 1/6 частина виплавленого чавуну. Тому боротьба з корозією - одна з найважливіших завдань людства.
Учитель. Чи володіють амфотерними з'єднання заліза?
(На поставлене запитання може відповісти сам учитель або заздалегідь підготовлений, який цікавиться хімією учень.)
Гідроксид заліза (III) амфотерен, т. Е. Проявляє властивості основи в реакції з кислотами:
і кислотні властивості в реакціях з концентрованими розчинами лугів:
Амфотерний характер має і оксид заліза (III), який реагує і з кислотами, і з основними оксидами:
Учитель загострює увагу учнів на те, що існують характерні реакції на сполуки двовалентного і тривалентного заліза, супроводжуючи свою розповідь проведенням дослідів.
Учитель. Для виявлення іонів заліза (III) зручно застосовувати комплексне з'єднання заліза, зване жовтої кров'яної сіллю або гексаціаноферрат (II) калію K4 [Fe (CN) 6]. При взаємодії іонів (Fe (CN) 6) 4 з іонами Fe 3+ утворюється темно-синій осад - берлінська лазур:
Інше з'єднання заліза - червона кров'яна сіль або гексаціаноферрат (III) калію K3 [Fe (CN) 6] є реактивом на іони Fe 2+.
При взаємодії іонів (Fe (CN) 6) 3 з іонами Fe 2+ також утворюється темно-синій осад - турнбулевої синь:
Перерахуйте основні області застосування заліза. Яке природне значення має залізо?
(Учні відповідають на поставлені питання, учитель пояснює їх відповіді.)
Перший учень. Ферати різних металів використовують в сучасних галузях радіоелектроніки та автоматики.
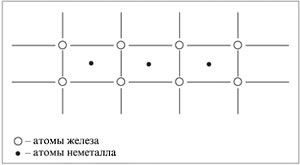
Другий учень. Незвичайні з'єднання утворює залізо з воднем, азотом і вуглецем. Атоми цих неметалів мають розміри менші за атоми заліза і легко впроваджуються між вузлів кристалічної решітки металу, утворюючи тверді розчини впровадження.
Для закріплення вивченого матеріалу учням пропонуються наступні питання.
1. Який стан заліза в періодичній системі хімічних елементів?
2. Які ступені окиснення виявляє залізо в з'єднаннях?
3. Які сполуки заліза мають амфотерними властивостями?
4. Як реагує залізо з азотної та сірчаної кислотами різної концентрації?
5. Як відрізнити сполуки дво- і тривалентного заліза?
6. Яке застосування і значення сполук заліза на сучасному етапі розвитку людства?
Якщо дозволяє час, то можна закріпити розглянутий матеріал по виробництву заліза, використовуючи наступні питання.
1. У чому перевага прямого методу отримання заліза?
2. Для чого застосовують збагачення руди?
3. Як збагачують руду методом флотації?
4. У чому основний сенс очищення технічного заліза карбонільним методом?