КАФЕДРА АКУШЕРСТВА І ГІНЕКОЛОГІЇ
Припинення кровотечі після травматичного пошкодження кровоносних судин називається гемостазу.
Виділяють чотири фази гемостазу:
· Перша фаза - скорочення пошкодженої судини. При цьому зменшується кровопостачання дистальної від травми області.
· Друга фаза - утворення в місці пошкодження пухкої тромбоцитарної пробки або білого тромбу. Наявний в ділянці пошкодження колаген служить сполучною центром для тромбоцитів; у останніх в результаті зв'язування руйнується їх внутрішня структура і вивільняються тромбоксан і ADP. Вони в свою чергу індукують приєднання нових тромбоцитів і таким чином утворюється пухка тимчасова пробка. Тривалість цієї фази гемостазу визначають за тривалістю кровотечі.
· Третя фаза - формування червоного тромбу (кров'яного згустку).
· Четверта фаза - часткове або повне розчинення згустку.
Розрізняють три типи тромбів або згустків:
· Білий тромб (перший тип) утворюється з тромбоцитів і фібрину; в ньому відносно мало еритроцитів. Формується він у місцях пошкодження або на патологічно зміненої стінки судини в умовах високої швидкості кровотоку (в артеріях).
· Другий вид тромбів - це дисеміновані відкладення фібрину в дуже дрібних судинах (капілярах).
· Третій вид тромбів - червоний тромб - складається з еритроцитів і фібрину. Морфологія червоного тромбу подібна до морфологією згустків, що утворюються в пробірці. Червоні тромби формуються in vivo в областях уповільненої кровотоку при відсутності патологічних змін в стінці судини, в місці пошкодження або на зміненої стінки судини слідом за ініціює тромбоцитарной пробкою.
- Ініціація утворення тромбу у відповідь на пошкодження тканини здійснюється за зовнішнім шляху згортання.
- Ініціація формування червоного тромбу в області уповільненої кровотоку або на аномальної судинної стінки при відсутності пошкодження тканини відбувається по внутрішньому шляху згортання.
- Зовнішній і внутрішній шляху згортання завершуються загальним кінцевим шляхом. На цьому етапі відбувається перехід протромбіну в тромбін і каталізує тромбіном перетворення фібриногену в фібрин тромбу.
Таблиця 1. Система нумерації факторів згортання крові.
Номери не відображають послідовності дії факторів
Перетворення фібриногену в фібрин, що каталізує тромбіном
Фібриноген (фактор I. см. Рис. 1 і табл. 1) - це розчинний глікопротеїн плазми, що синтезується в печінці, довжина його молекули 46 нм, мовляв маса 340000. Молекула складається з шести поліпептидних ланцюгів (дві А # 945; - ланцюги, дві В # 946; -ланцюга і дві # 947; -ланцюга). Структура фібриногену - А # 945; 2 В # 946; 2 # 947; 2. В # 946; - і # 947; - ланцюги містять складні олігосахариди, пов'язані з залишками Asn. Кінці молекул фібриногену володіють сильним негативним зарядом; це обумовлено присутністю великої кількості залишків аспартату та глутамату в А-області ланцюга А # 945; і в В-області області ланцюга В # 946; (Рис. 1). Крім цього В-область ланцюга В # 946; містить незвично негативно заряджений залишок тирозин-О-сульфату. Негативно заряджені кінці молекул фібриногену не тільки сприяють розчинності останніх у воді, вони відштовхують кінці інших молекул фібриногену, що запобігає агрегації останніх.
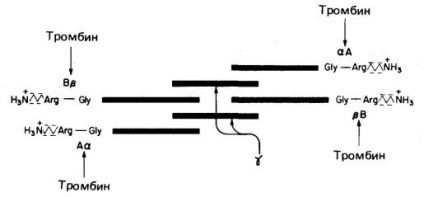
Мал. 1. Схематичне зображення фібриногену, його структури (А # 945; В # 946; # 947;) 2. заряджених кінців, сайтів розщеплення тромбіном (стрілки) чотирьох пептидних зв'язків Arg - Gly.
Тромбін - це серинові протеаза з мовляв. м ассой 34000, що складається з двох поліпептидних ланцюгів. Тромбін гідролізує чотири пептидні зв'язку Arg - Gly в фібриногену (рис. 1). З цих чотирьох зв'язків дві з'єднують області А і # 945 ;. а інші дві - області В і # 946; в ланцюгах А # 945; і В # 946; відповідно. Видаляються з молекули фібриногену фрагменти А і В є негативно зарядженими фібрінопептіда. в результаті утворюється мономер фібрину, який має структуру ( # 945; # 946; # 947; ) 2. Довгі нерозчинні мономери фібрину спонтанно асоціюють в регулярні звивисті структури; в результаті утворюється нерозчинний полімерний фібриновий згусток. Він захоплює еритроцити, тромбоцити і інші компоненти крові, в результаті чого утворюється червоний тромб або білий тромб (тромбоцитарная пробка). На ранній стадії фібриновий згусток є вельми пухке освіту, утримувати лише нековалентносвязанной системою нерозчинних фібрінових мономерів.
Функція тромбіну крім перетворення фібриногену в фібрин полягає в перекладі фактора XIII в його активну форму (XIII а). Фактор Х III а (трансглутамінази) «зшиває» мономери фібрину шляхом утворення специфічної ізопептідной зв'язку між # 947; - карбоксамідну групою глутаміну і # 949; -аминогруппами лізину (рис. 2). Така стабілізація фибринового згустку сприяє його ретракції. що можна спостерігати в пробірці. Підвищена кровоточивість, яка спостерігається у пацієнтів зі спадковою недостатністю фактора XIII. пояснюється неможливістю утворення стабільного фібринового згустку.
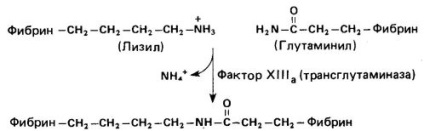
Мал. 2. Поперечна зшивання фібрінових молекул при дії активованого фактора XIII.
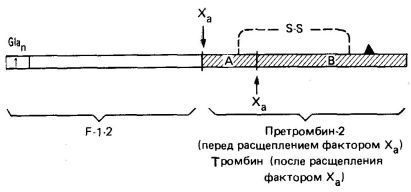
Мал. 3. Схематична будова протромбіну, N-кінець - зліва; область I містить всі залишки Gla. Показані сайти розщеплення фактором Х а і найменування продуктів розщеплення. Локалізація каталитически активного залишку серину позначена ▲. А- і В-ланцюга активного тромбіну (заштриховані) утримуються разом дисульфідні містком.
Активація протромбіну відбувається на тромбоцитах; в цьому процесі беруть участь аніонний тромбоцитарний фосфолипид. іони Са 2 +. фактори Va і Xa.
Фосфоліпіди, що знаходяться на внутрішній стороні плазматичної мембрани тромбоцитів, експонуються в результаті індукованого колагеном руйнування і дегрануляції тромбоцитів. Ці фосфоліпіди пов'язують іони Са 2 + і протромбін (останній, по N -концевой області, що містить залишки Gla). Тромбоцити містять також фактор V. який в активованої формі (Va) з'єднується зі специфічними рецепторами на мембрані тромбоцитів (рис. 4). Фактор Va служить рецептором для фактора Х а, який в свою чергу пов'язує протромбін в області F -1-2 (рис. 3). Фактор Х а також є серинових протеази, він розщеплює каталитически неактивну молекулу протромбіну в областях, зазначених на рис. 3. При цьому вивільняється N -концевая частина протромбіну. В результаті розщеплення тромбіну фактором Х а утворюються поліпептиди тромбіну А і В, пов'язані дисульфідні містком.
Зв'язування фосфолипида через іони Са 2 + з залишками Gla протромбіну підсилює процес активації останнього в 50-100 разів. Це відбувається, мабуть, внаслідок створення високої локальної концентрації протромбіну і фактори Х а (рис. 4). Фактор Va викликає посилення активації протромбіну приблизно в 350 разів також завдяки підвищенню локальної концентрації фактора X а.
Фактор Va. утворений під дією тромбіну з фактора V. згодом тим же тромбіном і інактивується, таким шляхом обмежується процес активації протромбіну в тромбін.
Протромбін може бути активований стафілокоагулазой в результаті конформаційних змін.
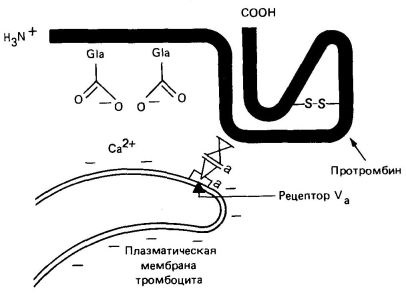
Мал. 4. Схема зв'язування факторів Va. Xa. іонів Са 2 + і протромбіну з мембраною тромбоцита.
Активація фактора Х
Зовнішній шлях утворення Ха фактора
Розрив зв'язку Arg - Ile. а отже і перетворення фактора Х в фактор Х а, на зовнішньому шляху здійснюють спільно фактор VII а й тканинний фактор. Фактор VII а функціонує тільки на зовнішньому шляху, який швидко включається після пошкодження тканини. Попередник фактора VIIa - фактор VII (ще один Gla -містять глікопротеїн) - синтезується в печінці і може активуватися тромбіном або фактором Х а. Фактор VII - це зимоген, проте він володіє високою ендогенної активністю. Тканинний фактор, що прискорює дію факторів VII або VIIa на фактор X. в більшій кількості міститься в плаценті, легких і мозку.
В 1 мл плазми міститься приблизно 3 мг фібриногену і тільки 0,01 мг фактора X. Це означає, що в системі згортання повинна мати місце ампліфікація. І дійсно, перетворення фактора X в Х а - аутокаталітіческій процес, який можна розглядати як ампліфікацію. У розглянутій групі реакцій нелегко зрозуміти, що є первинним - «курка чи яйце»; в даному випадку - фактор II а (тромбін) або фактор Х а (рис. 5).
Внутрішній шлях освіти фактора Х а
Внутрішній шлях освіти фактора Х а починається з взаємодії in vivo прекаллікреін. високомолекулярного кининогена. факторів XII і XI на активує поверхні, ймовірно на коллагене (рис. 6). Активує поверхнею внутрішнього шляху в дослідах in vitro служить скло і каолін. Взаємодія фактора XII з активує поверхнею робить його більш доступним для протеолітичної атаки КАЛІКРЕЇН. В результаті дії калікреїну утворюється фактор Х II а, який в свою чергу індукує перехід прекаллікреін в калікреїн. Таким чином, має місце реципрокная активація. Фактор Х II а вивільняє з високомолекулярного кининогена брадикинин і активує фактор XI в Х I а. Фактор Х I а в результаті двох послідовних реакцій активує фактор IX (Gla -містять зимоген). Фактор I Ха в присутності іонів Са 2 + і кислих фосфоліпідів повільно активує фактор X; активація відбувається шляхом розщеплення тієї ж зв'язку Arg - Il е, яку розщеплює фактор VIIa на зовнішньому шляху. Швидкість активації фактора X фактором I Ха збільшується в 500 раз в присутності фактора VIII (або VIIIa). Для активації фактора VIII. мабуть, необхідно невелику кількість тромбіну. Фактор VIII не є протеазой; ймовірно, він служить рецептором для фактора IX а при розщепленні останнім зв'язку Arg - Il е в факторі X. Внутрішній шлях згортання крові - повільний процес, оскільки в ньому бере участь велика кількість чинників. Всі разом вони утворюють каскадний механізм, що генерує фактор Х а (рис. 6).
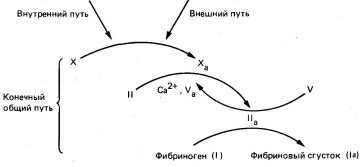
Мал. 5. Взаємозв'язок внутрішнього, зовнішнього і кінцевого спільного шляху в процесі згортання крові.
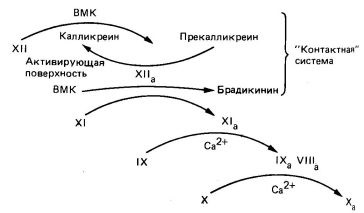
Мал. 6. Внутрішній шлях активації фактора X в Х а. ВМК - високомолекулярний кининоген.
Є цілий ряд спадкових хвороб людини, обумовлених недостатністю різних компонентів системи згортання. Найбільш часто спостерігається недостатність фактора VIII. детерминирующая гемофілію А (відповідний ген локалізований в 10-й хромосомі людини). Ця хвороба зіграла значну роль в історії королівських династій в Європі.
Нормальна плазма характеризується кількома видами антітромбіновой активності. Невеликий внесок в неї вносить # 945; 1 -антитрипсин. На частку специфічного # 945; 2-глобуліну припадає близько 25% всієї антітромбіновой активності плазми. Він утворює незворотний комплекс з тромбіном і іншими протеазами, перешкоджаючи таким чином зв'язування цих ферментів з їх природними субстратами. # 945; 2-глобуліну розглядається як # 945; 2-інгібітор плазміну, оскільки він інактивує також плазмин, що є серинових протеази з фібринолітичної активністю.
Найбільша антітромбіновой активність властива антитромбіну III. Антитромбін III володіє незначною ендогенної активністю і сильно активується в присутності гепарину, що володіє великим негативним зарядом. Гепарин, мабуть, зв'язується зі специфічним катіонних ділянкою антитромбіну III. викликаючи конформационное зміна його молекули. В результаті цієї зміни антитромбін III набуває можливість зв'язуватися з усіма серинові протеазами, включаючи трипсин, хімотрипсин і плазмін. В системі згортання крові антитромбін III пригнічує активність тромбіну, факторів I Ха, ха, Х I а і Х II а. У індивідів зі спадковою недостатністю антитромбіну спостерігається схильність до утворення тромбів. Звідси можна зробити висновок, що антитромбін виконує фізіологічні функції і що в нормі процес згортання крові у людини є дуже динамічну систему.
Гепарин часто використовується в клінічній практиці в якості препарату, що запобігає згортання крові. Головним фактором, що визначає противосвертиваючих активність гепарину, є активація їм антитромбіну III. який в свою чергу пригнічує розглянуті вище серинові протеази. Відомо, що невелика кількість гепарину знаходиться на стінках судин, внаслідок цього знижується активація внутрішнього шляху. Противосвертиваючих активність гепарину можна придушити сильно катіонними полипептидами (наприклад, протаміном). Такі поліпептиди конкурують з катіонними ділянками антитромбіну III за зв'язування з Поліаніонна гепарином.
Препарати групи кумарину інгібують вітамін-К-залежне карбоксилирование залишків Glu. що приводить до утворення Gla в N -концевой частини молекули факторів II. VII. IX і X. Всі ці фактори синтезуються в печінці, і утворення залишків Gla необхідно для їх дозрівання і, отже, для нормального функціонування внутрішнього, зовнішнього та загального кінцевого шляхів згортання. Мабуть, препарати кумарину інгібують відновлення хінонову похідних вітаміну К в активні гидрохиноновую форми. Введення вітаміну К знімає блок, що викликається кумарином, і забезпечує дозрівання в печінці Gla -залежних факторів згортання. Звернення дії кумарину вітаміном К спостерігається тільки через 12-24 год; звернення же протизгортаючої активності гепарину протаміном відбувається практично відразу; це різниця зумовлена природою антагоністичних механізмів.
Є переконливі дані, що свідчать про те, що система згортання крові в нормі знаходиться в динамічній рівновазі, при якому фібринові згустки постійно утворюються, а потім розчиняються. Плазмін є серинових протеазу, здатну гідролізувати фібриноген і фібрин, фактори V і VIII. фактори комплементу і різні поліпептидні гормони. У нормі плазмин міститься в плазмі у формі неактивного профермента (плазміногену). У більшості тканин організму є активатори плазміногену різних типів. Тканинний активатор плазміногену - це серинові протеаза, каталитически неактивна під час відсутності контакту з фібрином. Перебуваючи в контакті з фібрином, активатор плазміногену здатний розщеплювати молекулу плазміногена з утворенням плазміну. Коли плазмин гидролизует фібрин, активатор плазміногену втрачає свою активність і протеоліз загасає. Таким чином, забезпечується ефективна регуляція процесу фібринолізу. Вельми перспективним видається використання в терапевтичних цілях тканинного активатора плазміногену (ТАП), одержуваного методами генної інженерії. ТАП сприяє відновленню прохідності коронарних артерій, знижуючи, таким чином, пошкодження міокарда, що відбувається при гострому тромбозі коронарних судин. Ще один активатор плазміногену - протеолітичний фермент урокиназа - міститься в сечі. Урокіназа - це теж серинові протеиназа; вона може активувати плазміноген, розщеплюючи його в двох місцях.
Плазміноген в нормі осідає з фібрином і, отже, входить до складу фибринового згустку. Утворений в результаті активації плазмін розщеплює молекули фібрину на розчинні фрагменти, і згусток зникає (розчиняється). Фібринові згустки з поперечними сшивками, важче розчиняються плазміном.
Концентрація активаторів плазміногену підвищується при ряді захворювань, в тому числі при деяких формах раку і при шоці. Антіплазміновая активність, обумовлена # 945; 1-антитрипсину та # 945; 2-інгібітор плазміну, може знижуватися при цирозі печінки. Деякі бактеріальні продукти, наприклад стрептокиназа, здатні активувати плазміноген без розщеплення його молекули і можуть бути відповідальні за дифузні крововиливи, які іноді спостерігаються у хворих з дисемінований бактеріальними інфекціями.