Головне завдання біохімії полягає в тому, щоб досягти повного розуміння на молекулярному рівні природи всіх хімічних процесів, пов'язаних з діяльністю клітин. Для вирішення цього завдання необхідно виділити з клітин численні з'єднання, які там знаходяться, визначити їх структуру і встановити їх функції.
1.1.2. Між біохімією і медициною існує широка двосторонній зв'язок. Завдяки біохімічним дослідженням вдалося відповісти на багато питань, пов'язаних з розвитком захворювань. наприклад:
Вивчення дії токсину, що виробляється збудником холери, сприяло з'ясуванню механізмів виникнення клінічних симптомів (діарея, зневоднення) і розробці методів лікування цього захворювання.
Наявність у комарів - переносників збудників малярії - біохімічних систем, що забезпечують несприйнятливість їх до інсектицидів, враховується при розробці заходів по боротьбі з малярією.
Дослідження раціону гренландських ескімосів, які споживають у великих кількостях риб'ячий жир, багатий деякими поліненасиченими жирними кислотами, і рідко хворіють атеросклерозом, навело на думку про використання цих жирних кислот для зниження вмісту холестеролу в плазмі крові.
З іншого боку, вивчення причин і ходу розвитку деяких захворювань призвело до створення нових областей біохімії:
спостереження англійського лікаря Арчібальда Гаррода за хворими, що страждали вродженими порушеннями обміну речовин, стимулювали дослідження метаболічних шляхів, порушення яких відбувається при таких станах.
дослідження біохімічних процесів у хворих сімейної гіперхолестеролемія, що приводить до розвитку важкого атеросклерозу в ранньому віці, сприяли отриманню даних про клітинних рецепторах і про механізми поглинання холестеролу клітинами.
інтенсивне вивчення обміну речовин в клітинах злоякісних пухлин викликало інтерес до молекулярних механізмів контролю росту і розмноження клітин.
У процесі вивчення нашого курсу будуть представлені й інші приклади тісної взаємодії біохімії та медицини.
1.2.1. Основним об'єктом вивчення в нашому курсі є метаболізм - сукупність всіх хімічних реакцій, що відбуваються в клітині. Всі ці реакції, за невеликим винятком катализируются спеціалізованими білками - ферментами. Зрозуміти механізми протікання реакцій метаболізму неможливо без знання особливостей функціонування ферментів, механізмів їх регуляції. Властивості і механізм дії ферментів обумовлені їх хімічної природою. Тому вивчення курсу біохімії традиційно починають з розгляду особливостей структури і функції білків.
1.2.2. Як відомо з курсу біоорганічної хімії, всі білки побудовані з мономерів - α-амінокислот, що мають загальну формулу:
,
де R - радикал або бічний ланцюг.
Для амінокислот, що входять до складу білків, характерні наступні загальні властивості:
всі вони є α-амінокислотами. В організмі зустрічаються також амінокислоти з іншим розташуванням радикала, але до складу білків вони не входять;
так як у всіх амінокислотах (крім гліцину) α-вуглецевий атом пов'язаний з чотирма різними заступниками, то цей атом є асиметричним і амінокислоти мають оптичну активність (здатні обертати площину поляризованого світла в тому чи іншому напрямку);
амінокислоти, що містять асиметричний вуглецевий атом, належать до L-стереохімічні ряду. D-ізомерів амінокислот в білках організму немає;
в нейтральних водних розчинах амінокислоти знаходяться в вигляді біполярних іонів (цвіттер-іонів) і проявляють як кислотні, так і основні властивості.
Індивідуальні властивості кожної з амінокислот визначаються структурою її радикала. Повторіть формули 20 білкових амінокислот (рисунок 1.1) і їх скорочені позначення (таблиця 1.1).
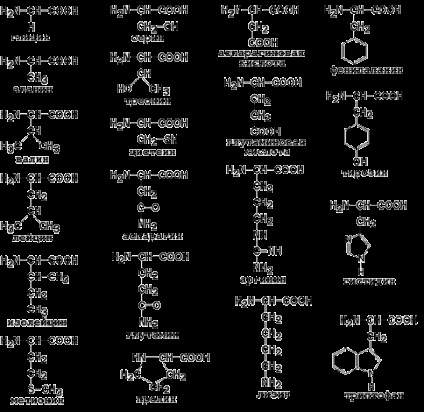
Малюнок 1.1. Формули амінокислот.
1.2.3. Білкові амінокислоти можна класифікувати, грунтуючись на полярності їх радикалів. Їх можна розділити на наступні групи: (рисунок 1.2).
1.3.1. Дві молекули однієї і тієї ж або різних амінокислот можуть ковалентно зв'язуватися один з одним за допомогою заміщений амідного зв'язку, яка називається пептидного. Пептидний зв'язок утворюється шляхом відщеплення угруповання ОН від α-карбоксилу однієї амінокислоти і атома водню від α-аміногрупи іншої амінокислоти. Пептидная одиниця має жорсткої структурою. Всі чотири атома розташовані в одній площині, причому водень NH-групи займає трансположеніе по відношенню до кисню карбонільної групи. Зв'язок між атомами вуглецю і азоту має частково характер подвійного зв'язку, і обертання навколо зв'язку з цим утруднено. У той же час по обидва боки від пептидного одиниці є високий ступінь свободи обертання щодо зв'язків С-Сα і Сα -N.
1.3.2. Амінокислоти здатні утворювати за допомогою пептидних зв'язків поліпептидні ланцюги. Послідовність чергування амінокислот у поліпептидного ланцюга називається первинною структурою білка. Пептиди відрізняються від білків невеликою кількістю амінокислотних ланок. Так, продукт взаємодії двох амінокислот, що містить пептидний зв'язок, носить назву дипептид, трьох амінокислот - трипептид, чотирьох - тетрапептид і т.д. В організмі людини пептиди утворюються, як правило, шляхом часткового гідролізу білків. Багато з таких пептидів мають високу біологічну активність, наприклад, вазопресин, окситоцин, брадикінін, тиреоліберином. енкефаліни.
Амінокислотні ланки пептиду або білка називаються амінокислотними залишками. Амінокислотний залишок, що містить вільну α-аміногрупу, називають N-кінцевим, а залишок, який має вільну α-карбоксильну групу, - С-кінцевим. Структурні формули пептидів записуються і читаються з N-кінця. Все амінокислотні залишки, що входять до складу поліпептиду (крім С-кінцевого), отримують закінчення іл замість ин. Для позначення амінокислот в поліпептидних ланцюгах у вітчизняній літературі використовують трьохбуквені скорочення (таблиця 1.1).

Малюнок 1. Приклад пептиду.
1.3.3. Навчіться записувати структурні формули пептидів. Запам'ятайте, що пептиди записуються і читаються з N-кінця. Спочатку пишеться структура пептидного остова, наприклад:
для тетрапептіда і так далі.
Потім до α-вуглецевим атомам приєднують бічні радикали, наприклад, трипептид фен-глу-ала записують наступним чином:
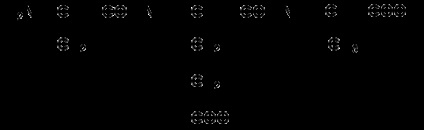
Певні труднощі викликає написання пептидів, що містять залишки проліну. В цьому випадку потрібно мати на увазі, що радикал пролина приєднується не тільки до α-вуглецевого атома, але і заміщає атом водню в α-аміногрупи. Наприклад, пептид тре-гли-про записується в такий спосіб:
1.3.4. Навчіться давати назви пептидів. Запам'ятайте, що все амінокислотні залишки, що входять до складу поліпептиду (крім С-кінцевого), мають закінчення іл замість ин (таблиця 1.1) Зверніть увагу, що назви залишків деяких амінокислот утворюються не за загальним правилом.
1.3.1. Дві молекули однієї і тієї ж або різних амінокислот можуть ковалентно зв'язуватися один з одним за допомогою заміщений амідного зв'язку, яка називається пептидного. Пептидний зв'язок утворюється шляхом відщеплення угруповання ОН від α-карбоксилу однієї амінокислоти і атома водню від α-аміногрупи іншої амінокислоти. Пептидная одиниця має жорсткої структурою. Всі чотири атома розташовані в одній площині, причому водень NH-групи займає трансположеніе по відношенню до кисню карбонільної групи. Зв'язок між атомами вуглецю і азоту має частково характер подвійного зв'язку, і обертання навколо зв'язку з цим утруднено. У той же час по обидва боки від пептидного одиниці є високий ступінь свободи обертання щодо зв'язків С-Сα і Сα -N.
1.3.2. Амінокислоти здатні утворювати за допомогою пептидних зв'язків поліпептидні ланцюги. Послідовність чергування амінокислот у поліпептидного ланцюга називається первинною структурою білка. Пептиди відрізняються від білків невеликою кількістю амінокислотних ланок. Так, продукт взаємодії двох амінокислот, що містить пептидний зв'язок, носить назву дипептид, трьох амінокислот - трипептид, чотирьох - тетрапептид і т.д. В організмі людини пептиди утворюються, як правило, шляхом часткового гідролізу білків. Багато з таких пептидів мають високу біологічну активність, наприклад, вазопресин, окситоцин, брадикінін, тиреоліберином. енкефаліни.
Амінокислотні ланки пептиду або білка називаються амінокислотними залишками. Амінокислотний залишок, що містить вільну α-аміногрупу, називають N-кінцевим, а залишок, який має вільну α-карбоксильну групу, - С-кінцевим. Структурні формули пептидів записуються і читаються з N-кінця. Все амінокислотні залишки, що входять до складу поліпептиду (крім С-кінцевого), отримують закінчення іл замість ин. Для позначення амінокислот в поліпептидних ланцюгах у вітчизняній літературі використовують трьохбуквені скорочення (таблиця 1.1).

Малюнок 1. Приклад пептиду.
1.3.3. Навчіться записувати структурні формули пептидів. Запам'ятайте, що пептиди записуються і читаються з N-кінця. Спочатку пишеться структура пептидного остова, наприклад:
для тетрапептіда і так далі.
Потім до α-вуглецевим атомам приєднують бічні радикали, наприклад, трипептид фен-глу-ала записують наступним чином:
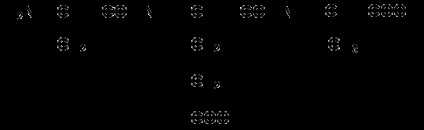
Певні труднощі викликає написання пептидів, що містять залишки проліну. В цьому випадку потрібно мати на увазі, що радикал пролина приєднується не тільки до α-вуглецевого атома, але і заміщає атом водню в α-аміногрупи. Наприклад, пептид тре-гли-про записується в такий спосіб:
1.3.4. Навчіться давати назви пептидів. Запам'ятайте, що все амінокислотні залишки, що входять до складу поліпептиду (крім С-кінцевого), мають закінчення іл замість ин (таблиця 1.1) Зверніть увагу, що назви залишків деяких амінокислот утворюються не за загальним правилом.
1. Суміш амінокислот, що містить триптофан і лізин. поділяли за допомогою хроматографії на папері. Яка з цих амінокислот після прояву хроматограм виявиться найбільш віддаленої від точки старту?
2. При частковому гідролізі білка отримані пептиди: а) тир-сер-арг-асп і б) мет-про-асп-лей. Який з цих пептидів краще розчиняється у воді?
3. В якому середовищі (кислої, лужної, нейтральної) знаходиться ізоелектричної точка пептидів: а) ала-вал-ліз-фен; б) цис-глу-три-мет?
4. В якому напрямку (до катода, до анода) будуть рухатися в електричному полі при pH 7,0 пептиди: а) арг-гли-ала-вал; б) лей-асп-глу-тир?
5. Пептид, що містить 9 амінокислотних залишків, був Гідролізований двома різними способами. У гидролизатах виявлені наступні набори пептидів:
про-тре-гіс; асп-сер-цис; тир-гли-арг;
гіс-тир; цис-про-тре; гли-арг; асп-сер.
Визначте амінокислотну послідовність вихідного пептиду.
1.5.2. Еталони рішення.
1. Більш віддаленим від точки старту виявиться триптофан, так як ця амінокислота містить гідрофобний радикал і краще розчиняється в органічному розчиннику - рухомій фазі при хроматографії на папері (див. 1.2).
2. У пептиді тир-сер-арг-асп всі чотири амінокислотних залишку є гідрофільними; в пептиді мет-про-асп-лей міститься один гідрофільний і два гідрофобних залишку амінокислот. Отже, перший пептид краще розчиняється у воді (див. 1.4).
3. а) Пептид ала-вал-ліз-фен містить позитивно заряджений амінокислотний радикал; отже, ізоелектричної точка пептиду знаходиться в лужному середовищі;
б) Пептид цис-глу-три-мет містить негативно заряджений амінокислотний радикал, тому ізоелектричної точка цього пептиду знаходиться в кислому середовищі (див. 1.4).
4. а) До складу пептиду арг-гли-ала-вал входить позитивно заряджений радикал, значить, в електричному полі при рН 7,0 цей пептид буде рухатися до катода;
б) До складу пептиду лей-асп-глу-тир входять два негативно заряджених амінокислотних залишку. Таким чином, даний пептид в електричному полі буде рухатися до анода (див. 1.4).
5. Для вирішення цього завдання в першому наборі пептидів необхідно знайти такі, в яких послідовність амінокислот частково збігається з послідовністю амінокислот в пептидах другої групи. Це дозволяє встановити, які пептидні зв'язку в початковому пептиді були гідроліз. Так, в першій групі є пептиди про-тре-гіс і асп-сер-цис; у другій групі - пептид цис-про-тре. Отже, у вихідному пептиді існував зв'язок між залишками цис і про і він містив фрагмент асп-сер-цис-про-тре-гіс. У другому наборі пептидів є дипептид гіс-тир, в першому випадку ці амінокислоти входять до складу різних тріпептідов. Значить, в вихідному пептиді була зв'язок між цими амінокислотами, і він мав наступну структуру: асп-сер-цис-про-тре-гіс-тир-гли-арг.