Лужні метали. Оксиди, пероксиди, гідроксиди та солі лужних металів
12.1. Загальна характеристика лужних металів
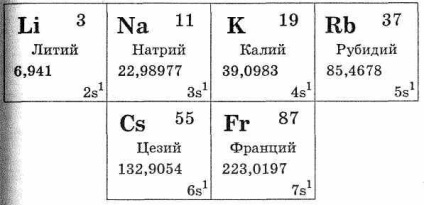
До групи лужних металів входить наступний ряд елементів: літій Li, натрій Na, калій К, рубідій Rb, цезій Cs, францій Fr. Вони знаходяться в головній підгрупі I групи періодічес-кою системи. Всі ці метали сходяться в тому відношенні, що на їхньому зовнішньому електронному шарі є один електрон (див. Табл. 28). Лужні метали відносяться до числа s-елементів. Електрон зовнішнього електронного шару атома лужного металу по порівняй-нію з іншими елементами того ж періоду віддалений від ядра, тобто радіус атома лужного металу найбільший в порівнянні з радіусом атомів елементів того ж періоду. У зв'язку з цим ва-лентний електрон зовнішнього шару атомів лужних металів легко відривається, перетворюючи їх в позитивно однозарядного іони. Цим обумовлено те, що з'єднання лужних металів з іншими елементами побудовані за типом іонної зв'язку.
В окисно-відновних реакціях лужні ме-Таллі поводяться як сильні відновники, і ця здатність Зростає від металу до металу зі збільшенням заряду ядра атома.
Фізичні та хімічні властивості елементів головної підгрупи I групи
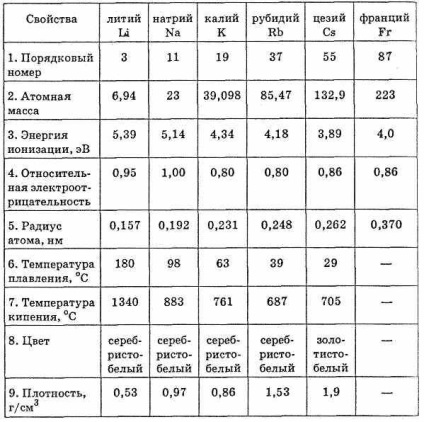
Серед металів лужні метали проявляють найбільш ви-сокую хімічну активність. В ряді напруг все щелоч-ні метали розташовуються на початку ряду. Електрон зовнішнього електронного рівня є єдиним валентним елек-троном, тому лужні метали в будь-яких з'єднаннях одно-валентні. Ступінь окислення лужних металів зазвичай 1.
Лужні метали легко окислюються на повітрі, у воді і кислотах. Щоб запобігти окисленню, їх зберігають в закритих (вакуумованих) судинах або під шаром ефіру, гасу і т.п. Окислення лужних металів в атмосфері кисню протікає дуже енергійно, причому утворюється при цьому пероксид металу типу R2 O2. Оксиди можуть бути отримані тільки при дотриманні особливих умов.
Оксиди лужних металів R2 O мають яскраво вираженими основними властивостями, активно реагують з водою, кислота-ми і кислотними оксидами.
При взаємодії лужних металів або їх оксидів з водою утворюються гідроксиди лужних металів - луги ROH - це сильні підстави, основні властивості яких мож-розтануть зі збільшенням атомного номера елемента. Відновлювальні властивості лужних металів виражені настільки сильно, що при нагріванні їх в атмосфері водню утворюються гідриди, в яких ступінь окислення водню дорівнює -1. Водневі сполуки лужних металів відповідають формулі RH. Це білі кристалічні речовини.
^ 12.2. Отримання і хімічні властивості лужних металів на прикладі натрію і калію
Знаходження в природі
Отримання натрію і калію
Натрій отримують шляхом електролізу хлориду або гідроксиду натрію. При електролізі розплаву NaCl на катоді виділяється натрій:
Na e - Na ° а на аноді - хлор: 2Сl - 2е - Cl 0 2
При електролізі розплаву NaOH на катоді виділяється натрій, а на аноді - вода і кисень:
Внаслідок дорожнечі гідроксиду натрію основним современ-ним методом отримання натрію є електроліз розплаву NaCl.
Калій також можна отримати електролізом розплавлених КС1 і КОН. Однак цей спосіб отримання калію не знайшов поширенням странения через технічні труднощі (низький вихід по току, труднощі забезпечення техніки безпеки). Сучасне про-промислове отримання калію засноване на наступних реакціях: KCl Na = NaCl K (1)
У способі (1) через розплавлений хлорид калію пропускають пари натрію при 800 ° С, а випари калію конденсатор-ють. У способі (2) взаємодія між розплавленим гідроксидом калію і рідким натрієм здійснюється протівото-ком при 440 ° С в реакційній колоні з нікелю.
Натрій і калій - сріблясто-білі метали, дуже м'які, легко ріжуться ножем.
Природний натрій складається з одного ізотопу 23 11 Na, калій - з двох стабільних ізотопів 39 19 K (93,26%) і 41 19 До (6,73%) і одного радіоактивного 40 19 K (0,01%). У дослідженнях застосовують радіо-активні ізотопи, одержувані штучним шляхом: 22, 11 Na,
Атоми натрію і калію при хімічній взаємодії ліг-ко віддають валентні електрони, переходячи в позитивно зоря-женние іони: Na і К. Обидва металу - сильні відновники.
Якщо натрій і калій окисляти в невеликій кількості киць-лорода при температурі близько 180 ° С, то виходять оксиди:
У зв'язку з легким і швидким окисленням натрію і калію їх зберігають під шаром гасу або парафіну, причому парафін пред-шанобливе, тому що в гасі все ж розчиняється деякий кіль-кість повітря, і окислення, хоча і повільне, все ж відбувається.
Натрій і калій можуть давати з'єднання з воднем - гід-Ріди, в якому водень виявляє ступінь окислення -1. Це солеподібний з'єднання, яке за характером хімічного зв'язку і величиною ступеня окислення відрізняється від летючих водо-
рідних з'єднань елементів головних підгруп IV - VII груп. Гідриди металів легко розкладаються водою з утворенням відпо-ветствующей лугу і водню:
Натрій і калій можуть реагувати не тільки з киснем і воднем, а й з багатьма простими і складними речовинами: 2Na S = Na2 S 2К Сl2 = 2КСl
Натрій і калій реагують не тільки з простими, а й зі складність ними речовинами, наприклад з водою, витісняючи з неї водень:
Калій реагує ще більш бурхливо, ніж натрій: 2К 2Н2 О = 2КОН H2
Який загорівся лужної метал не можна гасити водою. Його заливають мінеральним маслом або засипають сумішшю тальку з NaCl. Безбарвне полум'я газового пальника забарвлюється натрієм в жовтий колір, а калієм - в фіолетовий.
Натрій і його сплави з калієм використовують в якості тепло-носіїв в ядерних реакторах. Парами натрію наповнюють газо-розрядні лампи. Натрій - відновник в металургії (в; виробництві Ti, Zr, Та), застосовується в якості каталізатора в органічному синтезі та ін. Областях.
Калій застосовують в електротехніці, він є основним | живильним компонентом рослин.
^ 12.3. Оксиди, пероксиди, гідроксиди та солі лужних металів на прикладі натрію і калію
Оксиди натрію і калію особливого значення не мають. Вони енергійно реагують з водою, утворюючи їдкий натр і їдке калі відповідно:
Вони проявляють все властивості основних оксидів.
Пероксид натрію Na2 O2 - жовтуватий порошок. Його можна розглядати як своєрідну сіль пероксиду водню, бо його структура така ж, як у Н2 О2. Як і пероксид водню, перок-
сид натрію є найсильнішим окислювачем. При розчиненні в воді він утворює луг, пероксид водню і кисень:
Пероксид водню утворюється і при дії розбавлених кислот на пероксид натрію:
З вуглекислим газом повітря пероксид натрію реагує по рівнянню:
Тому його використовують в дихальних апаратах для реге-нераціі повітря - поглинання оксиду вуглецю (IV) і виділення кисню.
Пероксид натрію, крім того, застосовується для відбілювання тканин, кістки, волосся і ін.
Дуже важливими сполуками є гідроксид натрію, або їдкий натр NaOH, його називають також каустичною содою або каустиком, і гідроксид калію, або їдке калі КОН. Їх також називають їдкими лугами, тому що вони добре розчинні у воді.
Гідроксид калію і гідроксид натрію - білі непрозорі тверді кристалічні речовини. У воді розчиняються з виділенням-ленням великої кількості теплоти.
У водних розчинах практично без остачі дисоційований і є сильними лугами:
NaOHNa ОН - КОНК ОН -
Виявляють всі властивості підстав.
Тверді гідроксиди натрію і калію та їх водні розчини поглинають оксид вуглецю (IV):
У твердому стані на повітрі NaOH і КОН поглинають вологу, завдяки чому їх використовують як осушувачі газів.
У промисловості гідроксид натрію і гідроксид калію по-лучают електролізом концентрованих розчинів NaCl і КС1. При цьому одночасно виходить хлор і водень. Катодом слу-жит сітка, анодом - графіт.
Калії в ряду стандартних електродних потенціалів распо-хибна до алюмінію, і його іони відновлюються набагато працю-неї, ніж молекули води. Іонів Н в розчині дуже мало. Тому на катоді розряджаються тільки молекули води з виділенням мо-лекулярного водню. Хлорид-іони в концентрованому рас-творе легше віддають електрони (окислюються), ніж молекули води, тому на аноді розряджаються хлорид-іони.
Загальне рівняння електролізу в іонної формі:
Аналогічно протікає електроліз розчину NaCl. Розчин, що містить NaOH і NaCl, піддається упарювання, в результа-ті чого випадає в осад хлорид натрію (він має набагато мень-шую розчинність і вона мало змінюється з температурою), кото-рий відокремлюють і використовують для подальшого електролізу.
Анодна і катодного простір поділений діафрагмою для того, щоб утворюються продукти не вступали між собою у взаємодію, наприклад:
Сl2 NaOH = NaClO NaCl Н2 Про
Їдкий натр застосовують у багатьох галузях промисловості, наприклад, для очищення нафти, виробництва мила з жирів, в бу-мажной промисловості, у виробництві штучного волокна і барвників, виробництва медикаментів, в побуті та ін.
Більш дорогий продукт - гідроксид калію - застосовується рідше, ніж NaOH.
Натрій і калій утворюють солі з усіма кислотами. Майже всі їхні солі розчинні у воді. Найважливіші з них такі.
^ Хлорид натрію NaCl - необхідна приправа до їжі, ис-користується для консервування харчових продуктів, а також служить сировиною для отримання гідроксиду натрію, хлору, солячи-ної кислоти, соди та ін.
Застосування соди - див. Табл. 25 на стор. 303.
^ Сульфат натрію Na2 SO4 застосовують у виробництві соди і скла. З водних розчинів кристалізується десятіводний гид-
рат Na2 SO4 • 10Н2 О, званий глауберової сіллю. Застосовують в медицині як проносне.
Солі калію слід відзначити особливо, тому що деякі з них широко використовуються в якості добрив:
1) сирі солі, що представляють собою розмелені природні солі, переважно мінерали сильвініт NaCl • КСl і каи-ніт КСl • MgSO4 • 3Н2 O;
2) концентровані добрива, одержувані в результаті пере-ництва природних калійних солей, - це КСl і K2 SO4;
3) деревна і торф'яна зола, що містять поташ K2 CO3.