2. неметалів + неметалл = бінарна сполука.
Найчастіше неметали реагують з іншими неметалами при нагріванні, утворюючи бінарні сполуки (неметалл з більш низькою електронегативні виступає як відновник, з більш високою - як окислювач). Виняток становлять реакції між галогенами (крім F2) і киснем, тому оксиди галогенів отримують непрямими способами. F2. як найактивніший неметалл, при звичайних умовах реагує з усіма неметалами (з Н2 з вибухом).
3. Метал (в ряді напруг до Al) + H2O = гідроксид + H2.
Метал (в ряду напруг від Мn до H2) + H2Oоксід + H2.
Метал (в ряді напруг після H2) + H2O (немає реакції).
Метали, що стоять у ряді напруг по Al включно, взаємодіють з водою при звичайних умовах, утворюючи гідроксид металу і водень (Mg реагує при нагріванні, Al - при знятті щільної плівки оксиду Al2 O3. Be з водою не взаємодіє). наприклад:
2K + 2H2 O = 2KOH + H2.
Метали, що стоять у ряді напруг від Al до Н2. взаємодіють з перегрітою парою, утворюючи водень і оксид металу:
3Fe + 4H2 O = Fe3 O4 + 4H2, 2Cr + 3H2 O = Cr2 O3 + 3H2.
Метали, що стоять у ряді напруг після Н2. з водою не взаємодіють:
Cu + H2 O (немає реакції).
4. неметалів + вода.
При звичайних умовах з водою взаємодіє тільки F2. При цьому утворюється Складні суміш речовин, тому що виділяється атомарний кисень має високу хімічну активність:
Частково з водою взаємодіють Cl2 і Br2. проте рівновага цих реакцій сильно зміщене вліво:
Cl2 + H2 O HCl + HСlO, Br2 + H2 O HBr + HBrO.
Іноді цими реакціями нехтують, вважаючи, що мають справу з розчинами Cl2 і Br2 в воді - хлорного і бромної водою.
При високій температурі деякі неметали реагують з водяною парою:
З + H2 O = CO + H2, Si + 2H2 O = SiO2 + 2H2.
Взаємодія металів і неметалів з іншими сполуками буде вивчено пізніше.
Перевір себе
Вправа 1. Стрілками відзнач результати взаємодії води з металами.
Вправа 2. Закінчи рівняння реакцій:
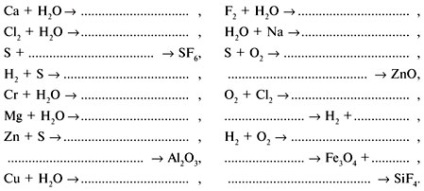
Вправа 3. Визнач, про яких елементах йдеться:
а) елемент А - рідкий при н.у. метал. ;
б) неметалл Б при взаємодії з водяною парою утворює пісок. ;
в) елемент В утворює два газоподібних простих речовини. ;
г) елемент Г утворює найлегше газоподібне при н. у. проста речовина. ;
д) оксид елемента Д - найпоширеніший на Землі.
Вправа 4. Склади рівняння реакцій відповідно до схем (в окремому зошиті):
а) З H2NaH H2H2 O KOH;
б) Cl2HCl H2H2 O HCl;
в) N2Ca3 N2NH3.
Вправа 5. За схемами реакцій визнач речовини A, В і С (А і В - прості, тобто складаються з атомів одного елемента):
A + B H2 O, B + Cl2C.
7.1. Kлассіфікація оксидів
Оксиди - сполуки атомів двох елементів, один з яких кисень в ступені окислення -2.
В оксидах атоми кисню пов'язані тільки з атомами іншого елемента і не пов'язані один з одним. Сполуки, що містять у своєму складі безпосередньо пов'язані один з одним атоми кисню (О-О-), називають пероксидамі.
Не утворюють оксидів тільки Hе, Ne, Аr і F. Розрізняють вищі оксиди. в яких атом елемента проявляє вищу ступінь окислення (зазвичай дорівнює номеру групи, в якій знаходиться елемент), і нижчі оксиди - ті, в яких атом елемента проявляє нижчу ступінь окислення. Оксиди, що містять атоми елемента в різних ступенях окислення, називають подвійними, наприклад:
Fe3 O4FeO • Fe2 O3. Mn3 O4MnO • Mn2 O3. Pb2 O3PbO • PbO2.
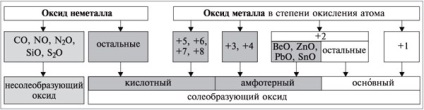
За хімічними властивостями оксиди поділяються на солеобразующіе (утворюють солі при взаємодії з кислотами і / або лугами) і несолеобразующіе (не утворюють солей, байдужі до кислот і лугів; до них відносяться СO, NO, N2 O, SiO, S2 O).
Багато солеобразующіе оксиди приєднують воду. Цей процес називається гідратацією, а його продукти - гідратами оксидів, або гидроксидами (містять одну або кілька гідроксигруп ОН).
Деякі оксиди з водою не взаємодіють, їх гідроксиди можна отримати непрямим шляхом.
Оксид і гідроксид відповідають один одному, якщо містять один і той же елемент з однієї і тієї ж ступенем окислення атома.
Солеобразующіе оксиди поділяють на основі вние, кислотні та амфотерні в залежності від типу відповідного гідроксиду. Kіслотно-осно вние властивості родинних оксидів і гідроксидів (Na2 O і NaOH, SO3 і H2 SO4) cовпадают.
Основними називають оксиди, яким відповідають гідроксиди - підстави.
Kіслотнимі називають оксиди, яким відповідають гідроксиди - кислоти.
Амфотерними називають оксиди, яким відповідають амфотерні гідроксиди.
Неметали утворюють тільки кислотні і несолеобразующіе оксиди; метали утворюють всі осно вние, все амфотерні і деякі кислотні оксиди. Багато метали побічних підгруп, що мають в з'єднаннях змінну С.О. атомів, можуть утворювати кілька оксидів і гідроксидів, характер яких залежить від С.О. атома елемента. З ростом ступеня окислення атома елемента його електронегативність зростає. Відповідно зростають неметалеві властивості елемента, а також кислотні властивості його оксиду та гідроксиду.
Оксиди металів в С.О. атомів +1 (Na2 O, K2 O і ін.), а також більшість оксидів металів в С.О. атомів +2 (FeO, MgO та ін.) є осно вним. Винятки: BeO, ZnO, PbO, SnO - амфотерні. Більшість оксидів металів в С.О. атомів +3 і +4 - амфотерні (Al2 O3. Cr2 O3. Fe2 O3. SnO2. PbO2 і ін.). Оксиди металів в С.О. атомів +5, +6, +7, +8 - кислотні (Mn2 O7. CrO3. Sb2 O5 і ін.) (схема 1).
Перевір себе
Вправа 1. Вибери зі списку формули оксидів, назви їх і склади їх графічні формули (в оксидах число зв'язків Е-О одно С.О. атома елемента, зв'язків О-О ні):
Вправа 2. Склади графічні формули речовин:
вуглекислий газ, чадний газ, закис азоту, негашене вапно, глинозем, палена магнезія, кремнезем, сірчистий газ.
Вправа 3. Не звертаючись до періодичної системи (ПС), визнач, в якій групі знаходяться хімічні елементи, що утворюють вищі оксиди:
Вправа 4. Склади формули вищих оксидів елементів з порядковими номерами 14, 34, 41, 75, 33, 50, 40, назви їх і визнач їх характер (основний, кислотний, амфотерний, несолеобразующіе).
Вправа 5. Змалюй графічні формули і вкажи характер оксидів:
а) азоту зі ступенями окислення атома +1, +2, +3, +5;
б) хлору зі ступенями окислення атома +1, +3, +5, +7;
в) марганцю зі ступенями окислення атома +2, +3, +4, +7.
Вправа 6. Склади формули і вкажи характер вищих оксидів всіх елементів: а) VIа групи ПС; б) 3-го періоду ПС. Kакая існує закономірність у зміні властивостей вищих оксидів елементів одного періоду?
Вправа 7. Визнач елементи за наступними даними:
а) елемент 3-го періоду, вищий оксид - Е2 ПРО5. ......................... ;
б) елемент 2-го періоду, вищий оксид - ЕО2. ......................... ;
в) елемент V групи ПС, утворює вищий оксид, в якому сумарне число протонів в молекулі менше 80, а сумарне число електронів більше 55, ...................... ;
г) елемент Х утворює два бінарних з'єднання з киснем, жодне з яких оксидом не є, ...................... ;
д) елемент Y утворює два газоподібних оксиду (С.О. рівні +2 і +4), один з них - несолеобразующіе ......................... ;
е) елемент Z у вигляді простого речовини входить до складу земної атмосфери, утворює два несолеобразующіе оксиду і кілька солеобразующіе ...............................
Вправа 8. Використовуючи літературні джерела, визнач агрегатний стан, колір і летючість наступних оксидів:
7.2. Оксиди і відповідні їм гідроксиди
Програма діяльності № 4
«Складання формули оксиду, відповідного гідроксиду»
прикладів вирішення завдань з Загальної хімії. Неорганіческойхіміі. Органічної хімії. Загалом охоплює всі теми. (Конструкційні формули хімічних речовин, степеньокісленія. Класи неорганічних речовин, складання хімічних формул: оксиди.
Робоча навчальна програма
формулами, степеньокісленія Тести з хімії Суровцева Р. П. Гузей Л .С. Попова О. А. Перевірочні роботи по неорганіческойхіміі Н.П. Гаврусейко.
електронегативність, валентність, степеньокісленія; -основні теорії хімії. будови органічних сполук. Неметали. Кислоти неорганічні і органічні. Основи неорганічні і органічні. Амфотерні неорганічні і органічні.
Робоча навчальна програма