Як вже зазначалося вище, одним з найважливіших параметрів, ха-рактерізует молекулу, є мінімальна потенційна енер-гія взаємодії EP0. Сили тяжіння, що діють між молекулами прагнуть скондесувати речовина, тобто зблизити його молекули до відстані r0 (рис.3), коли їх потенційна енер-гія взаємодії мінімальна і дорівнює EP0. але цього зближення перешкоджає хаотичний тепловий рух молекул. Інтенсивність цього руху визначається середньої кінетичної енергією молі-кули, яка має порядок kT. де k - постійна Больцмана. Агрегатні стани речовини істотно залежать від співвідношення величин EP0 і kT.
Припустимо, що температура даної системи молекул настільки висока, що kT >> EP0. В цьому випадку інтенсивний хаотичний тепловий рух заважає силам тяжіння з'єднати мо-лекул в агрегати з декількох частинок, сблизившихся до відстані r0. при зіткненнях велика кінетична енергія молекул буде легко розбивати ці агрегати на складові молекули і, таким чином, вірогідність утворення стійких агрегатів буде як завгодно малої. За цих обставин розглядаються молекули, очевидно, будуть перебувати в газоподібному стані.
Якщо температура системи частинок дуже низька, тобто kT < Нарешті, при температурі системи частинок, яка визначається з наближеного рівності kT ≈ EP0. кінетична енергія тепло-вого руху молекул, величина якої приблизно дорівнює потенціалу-ної енергії тяжіння, не зможе перемістити молекулу на расстоя-ня, що істотно перевищує r0. У цих умовах речовина буде перебувати в рідкому агрегатному стані. Таким чином, речовина, в залежності від своєї температури і величини EP0. властивої даному сорту складових його молекул, буде знаходитися в газоподібному, твердому або рідкому стані. При цьому температура переходу з одного агрегатного стану в інше визначається характерним для даної речовини (сорти молекул) числом EP0. Відомо, що у інертних газів (гелій, неон, аргон та ін.) Величина EP0 порівняно мала. Тому в широкому температурному інтервалі вони перебувають в газоподібному стані і переходять в рідину при досить низьких температурах, близьких до абсолютного нуля. У металів EP0. навпаки, як правило, велике. Тому до досить високих температур метали перебувають у твердому стані. Підсумовуючи, можна сказати, якщо речовина знаходиться при На закінчення цього параграфа відзначимо, які види рухів відчуває молекула речовини, що знаходиться в певному агрегатному стані. При нормальних умовах відстань між молекулами в газі в десятки разів (см.прімери параграфа 1.1) перевищують їх розміри; більшу частину часу вони рухаються прямолінійно без взаємодій-наслідком і тільки значно меншу частину часу, коли знаходять-ся на близьких відстанях від інших молекул, взаємодіють з ними, змінюючи напрямок свого руху. Таким чином, в газо-образному стані рух молекули виглядає так, як схематич-но показано на рис.6, а.
дуже низькій температурі, то молекули мають дуже малу кінетічес-кую енергію і сили тяжіння утримують молекули разом в упор-доченной щільно упакованої структурі, або решітці. При цьому молекули здійснюють коливання біля вузлів (положень рівноваги) кристал-вої решітки з амплітудою тим меншою, чим нижче температура. Якщо до кристалу підвести енергію, його температура підвищується, і молекули все сильніше коливаються щодо своїх рівноважних по-ложений. Якщо до кристалу підведена достатня енергія, то упорядкована структура молекулярного кристала руйнується кине-чеський енергією теплового руху і молекули отримують можливість вільно "ковзати" одна вздовж іншої, хоча як і раніше сопріка-саются один з одним. Ця ситуація відповідає рідкому стану, а температура переходу між кристалічним і рідким сос-тояніе визначається по порядку величини визначається з рівності kTпл = EP0. де Tпл - температура плавлення речовини. Рідина як і раніше утримується силами тяжіння, хоча молекули мають досить велику кінетичну енергію руху, щоб залишатися в фікс-рова положеннях рівноваги. Якщо до рідини підвести ще до-полнительную енергію, молекули починають рухатися досить швидко і здатні долати сили тяжіння, повністю відділяючись один від одного і рухаючись в просторі з незалежних траєкторіями. Ця ситуація відповідає газоподібному стану, а температура переходу між рідиною і газом називається температурою кипіння.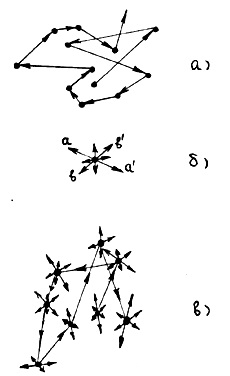
У твердому стані кожна молекула (атом) речовини знаходить-ся в рівноважному положенні (вузол кристалічної решітки), біля якого вона здійснює малі коливання, причому напрямок (до при-міру, аа 'на рис.6, б) і амплітуда цих коливань випадково змінюються (наприклад, на напрям bb ') через час, значно більше періоду цих коливань; частоти коливань молекул, розташованих в різних місцях, в загальному випадку, неоднакові. Траєкторія руху окремої молекули твердого тіла в загальних рисах представ-лена на рис.6, б.
Молекули твердого тіла упаковані так щільно, що відстань між ними приблизно дорівнює їх діаметру, тобто віддалі r0 на рис.3. З досвіду відомо, що щільність рідкого стану приблизно на 10% менше щільності твердого, при інших рівних умовах. Тому відстань між молекулами рідкого стану нес-колько більше r0. З огляду на, що в рідкому стані молекули про-ладают ще й більшої кінетичної енергією теплового руху, слід очікувати, що, на відміну від твердого стану, вони можуть, здійснюючи коливальний рух, досить легко міняти своє місце розташування, переміщаючись на відстань, істотно що не перевищує ний діаметр молекули. Траєкторія руху молекули рідини в головних рисах виглядає так, як схематично показано на рис.6, в. Таким чином, рух молекули в рідині поєднує в собі посту-пательня рух, як це має місце в газі, з коливальним, що спостерігається в твердому тілі.
Незважаючи на різний характер руху молекул в различ-них агрегатних станах, загальним є випадковість, непредска-зуемость цих рухів. Середня кінетична енергія цих беспор-дочних рухів визначає тепловий стан речовини, його темпе-ратуру.