Аміни - азотсодержащие органічні речовини, похідні аміаку (NH3), в молекулах яких один або кілька атомів водню заміщені на вуглеводневий радикал (- R або - CnH2n + 1)
Функціональна група: - NH2 аміногрупа
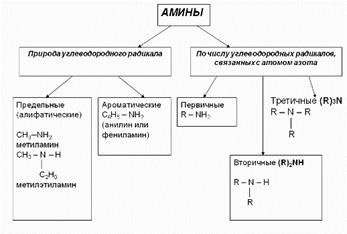
Номенклатура амінів 1. У більшості випадків назви амінів утворюють з назв вуглеводневих радикалів і суфікса амін.CH3-NH2 Метиламін CH3-CH2-NH2 етиламін Різні радикали перераховуються в алфавітному порядку. CH3-CH2-NH-CH3 Метілетіламін
При наявності однакових радикалів використовують приставки ді і три. (CH3) 2NH Диметиламін
2. Первинні аміни часто називають як похідні вуглеводнів, в молекулах яких один або кілька атомів водню заміщені на аміногрупи -NH2. В цьому випадку аминогруппа вказується в назві суфіксами амін (одна група -NH2), диамин (дві групи -NH2) і т.д. з додаванням цифр, що відображають стан цих груп в головній вуглецевого ланцюга.
Наприклад: CH3-CH2-CH2-NH2 пропанамін-1H2N-CH2-CH2-CH (NH2) -CH3 бутандіамін-1,3
6. Изомерия аміновСтруктурная ізомерія
- вуглецевого скелета, починаючи з С4H9NH2:
- ізомерія аміногрупи, пов'язана зі зміною ступеня заміщення атомів водню при азоті, тобто між типами амінів:
Отримання амінів. Через запах нижчі аміни довгий час приймали за аміак, поки в 1849 році французький хімік Шарль Вюрц не з'ясував, чи що на відміну від аміаку, вони горять на повітрі з утворенням вуглекислого газу. Він же синтезував метиламин і етиламін.
R-NO2 + 6 [H] t, kat-Ni → R-NH2 + 2H2O R-NO2 + 3 (NH4) 2S t, Fe в кислому середовищі → R-NH2 + 3S ↓ + 6NH3 ↑ + 2H2O
Інші способи: 1). Промисловий CH3Br + 2NH3 t, ↑ p → CH3-NH2 + NH4Br
2). Лабораторний - Дія лугів на солі алкіламмонія [R-NH3] Г + NaOH t → R-NH2 + NaГ + H2O
3). Дією галогеналканов на первинні аліфатичні і ароматичні аміниполучают вторинні і третинні аміни, в тому числі, змішані.
8. Фізичні властивості амінів.
При звичайній температурі тільки нижчі аліфатичні аміни CH3NH2, (CH3) 2NH і (CH3) 3N - гази (з запахом аміаку), середні гомологи - рідини (з різким рибним запахом), вищі - тверді речовини без запаху. Ароматичні аміни - безбарвні висококиплячі рідини або тверді вещества.Аміни здатні до утворення водневих зв'язків з водою:
Тому нижчі аміни добре розчинні у воді. Зі збільшенням числа і розмірів вуглеводневих радикалів розчинність амінів у воді зменшується, тому що збільшуються просторові перешкоди утворення водневих зв'язків. Ароматичні аміни в воді практично не растворяются.Анілін (фениламин) С6H5NH2 - найважливіший з ароматичних амінів: Анілін є безбарвною маслянистою рідиною з характерним запахом (т. Кип. 184 ° С, т. Пл. - 6 ° С). На повітрі швидко окислюється і набуває червоно-бурого забарвлення. Отруйний. Реакція горіння (повного окислення) амінів на прикладі метиламіни: 4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Це сполуки, що містять в молекулі одночасно гр. -NН2і ОН. Перший член гомологічного ряду
2-аміноетанол-1, моноетаноламін, коламін
Коламін входить до складу складних ліпідів. Похідне коламін - димедрол - має протиалергічну і слабким снодійним дією.
Коламін по гр. -NН2 проявляє властивості амінів і спиртів.
Р-ції, що протікають по-ОН гр: з Ме, РС15, НС1, R-C1, R-COC1; р-ції окислення і дегідратації.
1. Взаємодія з активними металами.
2. Взаємодія з РCl5 і НСl (реакції SN)
3. Взаємодія з галогеналканами:
4. Взаємодія з ангідридами кислот:
1. Взаємодія з сильними кислотами призводить до утворення стійких солей.
2. Взаємодія з водою.
3. Взаємодія з ангідридами кислот.
4. В реакції алкілування коламін утворює метилірованої похідне за типом четвртічного амонійного підстави - холін - тріметілоксіетілгідроксід амонію:
21. Карбонові кислоти та їх похідні. Загальна характеристика.
Карбоновими кислотами називаються сполуки, що містять карбоксильну групу
Класифікація. За кількістю карбоксильних груп карбонові кислоти ділять на монокарбонові, або одноосновні (одна група -СООН), дикарбонові, або двохосновні (дві групи -СООН) і т.д. Залежно від будови вуглеводневого заради-калу, з яким пов'язана карбоксильная група, карбонові кислоти бувають аліфатичними (наприклад, оцтова або акрилова), аліциклічними (наприклад, ціклогексанкарбоновая) або ароматичними (бензойна, фталева). У таблиці вказані деякі представники карбонових кислот. Номенклатура. В основі назв карбонових кислот лежать назви відповідних вуглеводнів. Наявність карбоксильної групи відбивається закінченням -овая кислота. Нижчі карбонові кислоти часто мають тривіальні назви: мурашина, оцтова, масляна і др.Углеводородную ланцюг нумерують починаючи з атома вуглецю карбоксильної групи, наприклад:
CH3 -CH = CH-COOH бутен-2-ова кислота
Часто карбоксильну групу розглядають як заступник в молекулі вуглеводню. При цьому в назві вживають словосполучення "карбонова кислота" і в нумерацію атомів вуглецю ланцюга атом вуглецю карбоксильної групи не включають: СН3 (СН2) 7 СН = СН (СН 2) 7 СООН Гептадецен-8-карбонова (олеїнова) кислота
Назви дикарбонових кислот виробляють від назви відповідного вуглеводню з додаванням суфікса "Діовен" і слова "кислота". Наприклад, етандіовая (щавлева) кислота (ноос-СООН).
При розгляді карбоксильної групи як заступника, назва двухосновной кислоти виробляють від назви вуглеводневої радикала з додаванням словосполучення "дикарбонових кислот". Наприклад, малонового кислоту (ноос-СН2-СООН) називають метандікарбоновой кислотою.
Ізомерія. У карбонових кислот можливі наступні види ізомерії:
1. Ізомерія вуглецевого ланцюга. Вона починається з бутанової кислоти (С3Н7СООН), яка існує у вигляді двох ізомерів:
2Ізомерія положення кратному зв'язку, наприклад:
СН2 = СН-СН 2-СООН СН3-СН = СН-СООН
Бутен-3-ова кислота Бутен-2-ова кислота
(Вінілуксусная кислота) (кретоновая кислота)
Цис-транс- ізомерія, наприклад:
цис -бутил-2-ова транс-бутен-2-ова
кислота кислота
4. Міжкласова ізомерія: наприклад, олійною кислоти (СН3-СН2-СН2-СООН) ізомерний метиловий ефір пропановой кислоти (СН3-СН2-СО-О-СН3) і етиловий ефір оцтової кислоти (СН3-СО-О-СН2-СН3) .
5. У гетерофункціональних кислот є ізомерія, пов'язаний-ва з положенням функціональних груп, наприклад, існують три ізомери хлормасляной кислоти:
СН3-СН2-СНСl-СООН СН3-СНСl-СН2-СООН
2-хлорбутановая кислота 3-хлорбутановая кислота
22. Фізичні та хімічні властивості карбонових кислот.
Фізичні властивості. Насичені аліфатичні монокар-бонові кислоти утворюють гомологічний ряд, який харак-теризують загальною формулою CnH2n + 1 COOH. Нижчі члени цього ряду при звичайних умовах являють собою рідини, обла-дають характерним гострим запахом. Наприклад, метанова (оцтова) кислота має характерний "оцтовий" запах. Безводдя-ва оцтова кислота при кімнатній температурі являє собою рідину; при 17 ° С вона замерзає, перетворюючись в льодово речовину, яка отримала назву "крижана" оцтова кисло-та. Середні представники цього гомологічного ряду - в'язкі, "маслоподібними" рідини; починаючи з С10 - тверді вещества.Кіслоти, що містять 1-3 вуглецевих атома, необмежено змішуються з водою.
Хімічні властивості. Карбонові кислоти - більш силь-ні кислоти, ніж спирти, оскільки атом водню в карбок-сильній групі володіє підвищеною рухливістю завдяки впливу групи СО. У водному розчині карбонові кислоти дисоціюють: RCOOH RCOO- + Н +
Проте через ковалентного характеру молекул карбоно-вих кислот вказане вище рівновагу дисоціації досить сильно зрушено вліво. Таким чином, карбонові кислоти - це, як правило, слабкі кислоти.
2. Освіта солей. Карбонові кислоти володіють усіма властивостями звичайних кислот. Вони реагують з активними метал-лами, основними оксидами, основами і солями слабких киць-лот:
Карбонові кислоти - слабкі, тому сильні мінеральні-ні кислоти витісняють їх з відповідних солей: CH3 COONa + HCl → СН3 СООН + NaCl.
Солі карбонових кислот у водних розчинах гідроліз: СН3 СООК + Н2 Про СН3 СООН + КОН. 4. Ряд властивостей карбонових кислот обумовлений наявністю вугле-водневого радикалу. Так, при дії галогенів на кислоти в присутності червоного фосфору утворюються галогензамещенние кислоти, причому на галоген заміщається атом водню при со-Седнів з карбоксильною групою атомі вуглецю (а-атомі):
Мурашина кислота НСООН відрізняється рядом особливостей, оскільки в її складі є альдегидная група:
Мурашина кислота - сильний відновник і легко окис-ляется до СО2. Вона дає реакцію "срібного дзеркала":
Крім того, мурашина кислота окислюється хлором: НСООН + Сl2 → СО2 + 2HCl.
В атмосфері кисню карбонові кислоти окислюються до СО2 і Н2 Про: СН3 СООН + 2О2 → 2СО2 + 2Н2 О.
6. Реакції декарбоксшірованія. Насичені незаміщені монокарбонові кислоти через великий міцності зв'язку С-С при нагріванні декарбоксилируется насилу. Для цього необ-обхідно сплавом солі лужного металу карбонової кислоти з лугом:
23. Амінокислоти. Загальна характеристика: будова, номенклатура, ізомерія.
Амінокислотами називають з'єднання, в яких одночасно містяться аминная і карбоксильная групи. Найпростіші амінокислоти мають тривіальні назви. Зазвичай же їх називають як заміщені відповідних кислот, позначаючи положення аминогрупп щодо кислотної буквами # 945 ;, # 946 ;, # 947 ;, # 948; і т. д. Використовується також назви по номенклатурі ІЮПАК:
гліцин, глікокол, амінооцтова, аміноетановая
лізин, # 945;, # 948; -діамінокапроновая, 2,6-діаміногексановая
Амінокислоти можуть містити одну або кілька кислотних груп і відрізнятися за основності. В молекулу амінокислоти може також входити і кілька аминогрупп. Залежно від взаємного розташування аміно- і карбоксильної груп амінокислоти поділяють на # 945; -, # 946; -, # 947; -, # 948; -, # 949; - і т. Д.
2. В залежності від кількості функціональних груп розрізняють кислі, нейтральні та основні.
3. За характером вуглеводневого радикала розрізняють аліфатичні (жирні), ароматичні, сірковмісні та гетероциклічні амінокислоти. Наведені вище амінокислоти відносяться до жирного ряду. Прикладом ароматичної амінокислоти може служити пара-амінобензойна кислота:
Прикладом гетероциклической амінокислоти може служити триптофан - незамінна # 945; - амінокислота
НОМЕНКЛАТУРа.По систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот додатком приставки аміно- і зазначенням місця розташування аміногрупи по відношенню до карбоксильної групи. Нумерація вуглецевого ланцюга з атома вуглецю карбоксильної групи.
ІЗОМЕРІЯ1. Ізомерія вуглецевого скелета
2. Ізомерія положення функціональних груп
3. Оптична ізомерія
# 945; -амінокислоти, крім гліцину NН2-CH2-COOH.