визначення
pH визначається як негативний логарифм активності іона водню, aH +, в растворе.Такім чином: pH = - log (aH +)
Технологія вимірювання pH
pH вимірюється з використанням установки двох електродів: вимірювальний електрод і контрольний електрод. Ці два електроди часто поєднуються в одному, який називається «комбінованим електродом». Все pH-електроди, що поставляються FLS, є «комбінованими».
Коли два електроди занурюються в розчин, утворюється невеликий гальванічний елемент. Створюваний потенціал залежить від обох електродів.
Виміряна напруга може виражатися рівнянням Нернста наступним чином:
E = Emeas - Eref = E0 - (2,303RT / F) pH де
E = виміряне напруга
Emeas = напруга вимірювального електрода
Eref = напруга контрольного електрода
E0 = потенціал стандартного електрода
R = газова постійна
T = абсолютна температура
F = постійна Фарадея
Крім того, це означає, що співвідношення між pH і E лінійно корелюється з температурою.
Значення крутизни характеристики при + 25 ° C становить 59,18 мВ / pH. Воно знаходиться близько 54 мВ / pH при + 5 ° C і близько 62 мВ / pH при + 40 ° C. При + 100 ° C крутизна збільшується приблизно до 74 мВ / pH.
Технічні терміни pH
Визначення відхилення і крутизни кривої системи pH.
Для оцінки характеристик обох електродів калібрування повинна виконуватися для обох точок pH.
Калібрування на розчині проби може проводитися для дослідження хімічних речовин, що можуть вплинути на вимірювання pH.
калібрувальний розчин (буферні рідини)
Розчин з відомим значенням pH, який використовується для калібрування системи pH.
На калібрувальні розчини впливає температура.
Залежність буферних рідин від температури добре відома.
Далі вказана залежність буферних рідин, що поставляються FLS:
Для порівняння показники pH часто співвідносяться з певною температурою, зазвичай + 25 ° C.
автоматична температурна компенсація
Алгоритми для автоматичного перетворення проби pH в контрольну температуру.
Ця функція враховує зміни кривої РН в залежності від температури.
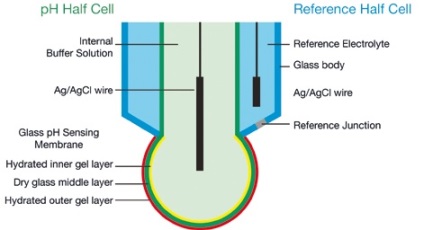
Принцип роботи pH-електрода
pH-електрод являє собою дуже високоімпедансних гальванічний елемент, в якому потенціал, утворений між напівелементах pH і контрольним напівелементах, є сумою різних потенціалів. На малюнку A показаний типовий скляний комбінований pH-електрод, в якому pH-напівелемент і контрольний напівелемент поєднуються в одній конструкції.
В ідеалі всі потенціали є постійними, крім одного, генерованого на зовнішньому гідратованому гелевом шарі, який залежить від pH-проби відповідно до рівняння Нернста.
Реальні електроди відрізняються від ідеального електрода через різних факторів, в тому числі:
1) виробничих допусків;
2) старіння електрода;
3) відновлення і чищення електрода.
Всі вимірювачі pH враховують калібрування або стандартизацію електрода для компенсації вищевказаних ефектів. Стандартна калібрування включає вимір відгуку електрода в двох буферних розчинах pH з добре відомими значеннями pH, і створення лінійної карти відгуку електрода на ці два пункти. Ці результати у вигляді коригувальних коефіцієнтів відхилення і крутизни кривої, де відхилення є відображенням мВ при pH 7, а крутизна кривої є зміною відгуку мВ на одиницю pH, зазвичай вираженою в мВ / pH, є відсоток їх ідеальною крутизни кривої електрода (59,16 мВ / pH при + 25 ° C).
Вимірювання ОВП
визначення
Окислювально-відновний потенціал (ОВП) є виміром тенденції розчину до окислення або до раскислению того, що може перебувати в контакті з ним.
Розчин окислювача є рідиною, яка прагне отримати електроди, що окислюють те, що з ними в контакті, розкисла себе.
Раскисляют розчин є рідиною, яка прагне втратити електроди, раскисляющие те, що з ними в контакті, окислюючи себе.
Технологія вимірювання ОВП
ОВП електрод створює напругу, так само як pH-електрод. У цьому випадку на вимір впливають не тільки іони водню, але і всі хімічні речовини, які можуть віддавати або приймати електрони.
Хоча на ОВП впливає температура і, в принципі, він слід рівняння Нернста, складно компенсувати вимір, так як зазвичай невідомо, скільки електронів залучено в реакції Redox (якщо вимір ОВП використовується тільки для моніторингу реакції, можливо визначити основну залучену полуреакции, і тому це можна зробити).
У вимірі ОВП також використовується установка двох електродів: вимірювальний електрод і контрольний електрод. Ці два електроди часто поєднуються в одному, який називається «комбінованим електродом». Все ОВП-електроди, що поставляються FLS, є «комбінованими». Коли два електроди занурюються в розчин, утворюється невеликий гальванічний елемент.
Створюваний потенціал залежить від обох електродів і, як правило, становить від -1000 мВ до +1000 мВ.
Хоча це вимір не пов'язане з конкретною рідиною, може виявитися вельми корисно спостерігати і контролювати активність певних сумішей. На практиці використання ОВП для моніторингу і контролю реакцій окислення-розкислення застосовується для руйнування ціаніду, дехлорування, окислення нітриту і гидросульфита, розкислення хромата, відбілювання гіпохлоритом, а також для моніторингу скрубберов хлору і двоокису хлору з використанням бисульфита. Вимірювання концентрації за допомогою ОВП проблематично, але ОВП можна використовувати в деяких випадках для виявлення витоків, щоб визначити наявність окислювача або раскислителя.
Нарешті, в деяких випадках ОВП вимірюють для регулювання біологічного зростання мікроорганізмів. Принцип такого застосування полягає в тому, що при мінімальному значенні ОВП мікроорганізми будуть успішно знищуватися. Цей підхід використовується в хлорування плавальних басейнів і градирень. Слід зазначити, що в обох цих випадках застосування також проводиться регулювання pH.
Технічні терміни ОВП
Визначення відхилення системи ОВП.
Для більшості випадків застосування ОВП абсолютна точність менш важлива, ніж швидкість і відносні зміни в системі. Для багатьох процедур і технічних умов потрібні шукані значення ОВП з допуском ± 25 мВ або ± 50 мВ, або вказуються зміни в ОВП, наприклад, падіння на 400 мВ кінцевого значення. Оскільки показник ОВП застосовується в різноманітних випадках з власними спеціалізованими методиками зчитування шуканих показників або змін показників, заснованих на досвіді, ми не можемо детально розробляти методики. Досить сказати, що точність, необхідна для вимірювань pH і інших електрохімічних вимірювань, як правило, не застосовується для ОВП, тому калібрування електродів і вимірників ОВП не є такою загальноприйнятою.
Розчин з відомим значенням ОВП, який використовується для перевірки системи ОВП.
Як пояснювалося вище, абсолютне значення ОВП не так важливо, тому калібрувальний розчин ОВП може застосовуватися тільки для перевірочних цілей.
В основному калібрувальний розчин або контрольний розчин ОВП призначений тільки для спрощення порівняння.
Іншими словами, оцінка відхилення може бути обов'язковою в разі заміни електрода, коли новий датчик вимірює інше значення в порівнянні з попереднім електродом, тому калібрування може знадобитися для звірки нового значення з попереднім. Наприклад, якщо за методикою потрібно шукане значення 410 мВ, певне за допомогою попереднього електрода і приладу, показання нового електрода з тим же приладом може скласти 425 мВ в тій же рідини. Використання калібрування або, точніше, регулювання відхилення може усунути цю різницю в 15 мВ, уникнувши плутанини. Потім при зчитуванні наступних показань їх можна буде легко порівнювати з показаннями колишнього електрода.
Принцип роботи ОВП-електрода
Принцип вимірювання ОВП полягає в використанні електрода з інертного металу (платина, іноді золото, рідше срібло), який, завдяки низькому опору, буде віддавати електрони окислювача або приймати електрони від раскислителя. ОВП-електрод буде продовжувати приймати або віддавати електрони, у міру розвитку потенціалу, завдяки накопиченню заряду, рівного ОВП розчину. Як правило, точність вимірювання ОВП становить ± 5 мВ. Також для ОВП-електрода потрібно контрольний електрод, який зазвичай є тим же електродом срібло-хлористе срібло, який використовується і для вимірювання pH.
Вимірювання Провідності
визначення
Провідність є здатністю розчину проводити електричний струм. У розчинах ток переноситься катіонами і аніонами.
Здатність розчину проводити електрику залежить від ряду факторів:
- концентрація
- мобільність іонів
- валентність іонів
- температура
Всі речовини мають різну ступінь провідності. У водних розчинах рівень іонної сили змінюється від низької провідності надчистої води до високої провідності концентрованих хімічних проб.
Технологія вимірювання провідності
Провідність можна вимірювати, подаючи електричний струм (I) на два електроди, занурених у розчин, і вимірюючи результуюча напруга (V). В ході цього процесу катіони мігрують до негативного електроду, а аніони - до позитивного електрода, і розчин діє як провідник електрики.
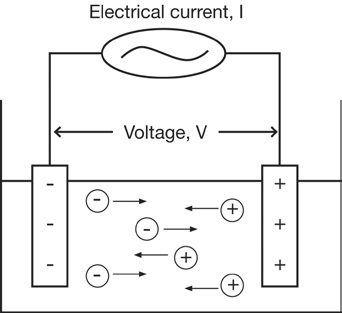
Опір розчину (R) можна розрахувати, використовуючи закон Ома
(V = R x I).
R = V / I
де:
V = напруга (вольт)
I = струм (ампер)
R = опір розчину (ом)
Провідність (G) визначається як зворотна величина електричного опору (R) розчину між двома електродами.
Фактично вимірювач електропровідності вимірює електропровідність і відображає показання, перетворене в провідність.
Це співвідношення між відстанню (d) між електродами і площею (а) електродів.
K = d / a
K = постійна елемента (див-1)
a = ефективна площа електродів (см2)
d = відстань між електродами (см)
Електрика є потік електронів. Це означає, що іони в розчині будуть проводити електрику. Провідність є здатністю розчину проводити струм. Показання провідності проби змінюються в залежності від температури.
C = G x K
C = провідність (S / см)
G = провідність (S), де G = 1 / R
K = постійна елемента (див-1)
Це зворотна величина значенням провідності, яка вимірюється в ом • см. Зазвичай вона обмежується виміром чистої води, провідність якої дуже низька.
Для визначення постійної елемента необхідно перетворити показання електропровідності в результати провідності.
Розчин з відомим значенням провідності, який використовується для калібрування системи провідності.
Для порівняння показники провідності часто співвідносять з певною температурою, зазвичай + 18 ° C, + 20 ° C або + 25 ° C.
автоматична температурна компенсація
Алгоритми для автоматичного перетворення провідності проби в контрольну температуру.
коефіцієнт температурної компенсації
Коефіцієнт, який використовується для автоматичної компенсації. Як правило, виражається в% / ° C.
Для використання з надчистої водою (UPW) з вимірювальними приладами FLS є спеціальна кореляція, заснована на ASTM D1125-19.
загальна кількість розчинених твердих речовин (TDS)
Це вимір загальної концентрації іонних речовин в пробі.
Прилад калибруется по стандартному розчину або за сольовим розчину, який користувач вирішив використовувати в якості контрольного зразка.
Показання провідності перетворюються в показання TDS множенням на відомий математичний коефіцієнт. Коефіцієнт залежить від контрольного складу (зазвичай сольового), використовуваного для приготування стандартного або контрольного матеріалу. Наприклад: морська вода містить безліч різних солей, але головним чином NaCl, тому користувач може зіставляти тільки з нею. Ось кілька прикладів коефіцієнтів:
діапазон коефіцієнта перетворення
Технічні терміни провідності
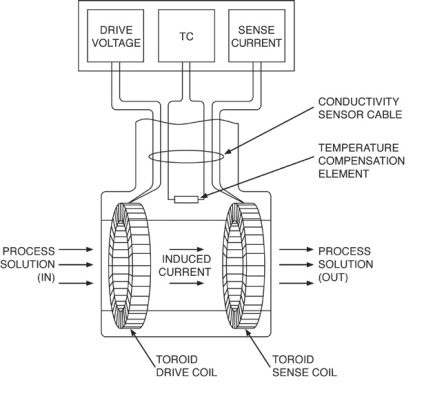
індуктивний тороидальний прилад для вимірювання провідності
Індуктивний тороидальний датчик провідності складається з двох високоякісних тороідов (котушок), концентрично і поруч один з одним вбудованих в непровідний корпус. Котушка первинної обмотки збуджується синусоїдальною напругою змінного струму, створюючи змінне магнітне поле. Це змінне магнітне поле змушує іони в розчині переміщатися через центр тороида. Рух іонів еквівалентно змінному струмі, що проходить через центр тороида. Змінний струм виробляє змінний струм у вимірювальній котушці, який пропорційний провідності розчину. В ідеалі сигнал в вимірювальної котушці повинен обумовлюватися тільки переміщенням іонів, а не змінним магнітним полем, створюваним первинної обмоткою. З цієї причини між котушками необхідно гарне магнітне екранірваніе.
завантажити PDF
Створення сайту «Дефі»