Атом - електронейтральна система, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Ядра атомів складаються з двох типів часток (нуклонів) - протонів (р) і нейтронів (n). Заряд протона дорівнює за величиною і протилежний за знаком заряду електрона; маса його дорівнює приблизно однієї а.е.м. Нейтрон - незаряджена частинка з масою, приблизно рівною масі протона.
Лінійні розміри атома -
Основна маса атома зосереджена в ядрі і характеризується масовим числом А, що дорівнює сумі чисел протонів (заряду ядра) Z і нейтронів N: А = Z + N.
Головною характеристикою атома є заряд ядра (Z). Він визначає число електронів, що знаходяться навколо ядра, тобто приналежність атома до даного виду хімічних елементів, і відповідає атомному номеру (в періодичній системі елементів - порядковому номеру) елемента.
В позначенні атома елемента відображаються масове число і кількість протонів -, наприклад.
Відносна атомна маса елемента є середньою величиною масових чисел його природних ізотопів з урахуванням ступеня їх поширення. Наприклад, хлор в природі знаходиться в основному у вигляді двох ізотопів - (75,43%) і (24,57%). Відносна атомна маса хлору становить.
Основою сучасної теорії будови атома є закони і положення квантової (хвильової) механіки - розділу фізики, що вивчає рух мікрооб'єктів.
Мікрооб'єкти мають одночасно корпускулярними і хвильовими властивостями. Для опису руху мікрочастинок використовується імовірнісний підхід, тобто визначається не їх точне положення, а ймовірність знаходження в тій чи іншій області околоядерного простору.
Стан електрона в атомі описується за допомогою квантово-механічної моделі - електронної хмари, щільність відповідних ділянок якого пропорційна ймовірності знаходження електрона. Зазвичай під електронним хмарою розуміють область околоядерного простору, яка охоплює приблизно 90% електронного хмари. Ця область простору називається також орбиталью.
Існує система квантових чисел, яка визначає стан електрона в атомі.
Головне квантове чіслоn визначає енергію електрона і розмір електронного хмари. Воно може приймати цілочисельні значення від 1 до.
Сукупність електронних станів, що мають однакове значення головного квантового числа n. називається електронним шаром або енергетичним рівнем.
Найменше значення енергії Е відповідає n = 1. Іншим квантовим станам відповідають більш високі значення енергії. Електрони, що знаходяться на цих енергетичних рівнях, менш міцно пов'язані з ядром.
Для атома водню квантовий стан з n = 1 відповідає його найменшої енергії і називається основним. Стану n = 2, 3, 4 ... називаються збудженими.
Орбітальний (побічна) квантове число визначає орбітальний момент кількості руху електрона і характеризує форму електронного хмари. Воно приймає всі цілочисельні значення від 0 до (n -1). Кожному n відповідає певне число значень, тобто енергетичний рівень являє собою сукупність енергетичних підрівнів, кілька розрізняються по енергіях. Число підрівнів, на яке розщеплюється енергетичний рівень, дорівнює номеру рівня (тобто чисельним значенням n). Ці підрівні мають наступні буквені позначення:
Орбітальний квантове число: 0 1 2 3 4
Підрівень: s p d f g
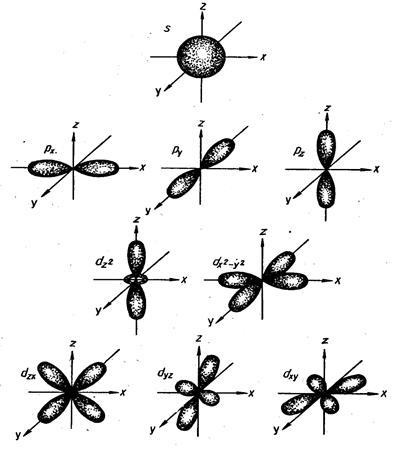
Форми орбіталей, які відповідають різним значенням, наведені на наступному малюнку:
Періодичний закон, відкритий Д.І. Менделєєвим в 1869 р в сучасному формулюванні говорить:
властивості хімічних елементів, а також форми і властивості утворених ними сполук перебувають у періодичній залежності від величини заряду ядер їх атомів.
Заряд ядра (число протонів) дорівнює атомному номеру елемента, визначає число електронів в атомі і, як наслідок цього, будова його електронної оболонки в основному стані.
Графічним зображенням періодичного закону є таблиця періодичної системи елементів. Форми такого зображення різні.
Принциповий підхід до побудови таблиць єдиний - елементи розташовуються в порядку зростання заряду ядер їх атомів. Фізичною основою структури періодичної системи елементів служить певна послідовність формування електронних конфігурацій атомів у міру зростання порядкового номера елемента Z.
Залежно від того, який енергетичний підрівень заповнюється електронами останнім, розрізняють 4 типи елементів:
1. s-елементи - останнім заповнюється s-підрівень зовнішнього енергетичного рівня;
2. p-елементи - p-підрівень зовнішнього енергетичного підрівня;
3. d - елементи - d-підрівень передостаннього енергетичного рівня.
4. f-елементи - f-підрівень третього зовні рівня.
Елементи з подібною електронною конфігурацією (заповнюються однотипні підрівні) зовнішніх енергетичних рівнів мають і подібними хімічними властивостями.
Періодом називається послідовний ряд елементів, електронна конфігурація зовнішнього енергетичного рівня яких змінюються від ns1 до ns2np6 (для першого періоду s1 і s2). При цьому номер періоду збігається зі значенням головного квантового числа і зовнішнього енергетичного рівня.
Кожен з періодів (виключаючи перший) починається типовим металом і закінчується благородним газом, якому передує неметалл, тобто в періоді зі збільшенням заряду ядра атомів спостерігається поступова зміна властивостей від металевих до типово неметаллическим, що пов'язується зі збільшенням числа електронів на зовнішньому енергетичному рівні.
Перші три періоди створюють s- і p- елементи. Четвертий і наступні - включають в свій склад також елементи, у яких відбувається заповнення d- і f-підрівнів відповідних внутрішніх енергетичних рівнів. f-елементи об'єднуються в сімейства, звані лантаніди (4f-елементи) і актинідії (5f-елементи).
У вертикальних колонках, званих групами, об'єднані елементи, які є подібними за електронну будову. У короткопериодной варіанті таблиці всього 8 груп, кожна з яких складається з головних і побічних підгруп. У елементів головних підгруп останніми заповнюються s- і p- підрівні зовнішніх енергетичних рівнів, електронні конфігурації яких є основним чинником, що визначає хімічні властивості елементів. У елементів побічних підгруп відбувається заповнення внутрішніх (n-1) d- і (n-2) f-підрівнів при наявності на зовнішньому енергетичному рівні 1 - 2 електронів.
Елементи-аналоги мають однакову будову зовнішніх електронних оболонок атомів при різних значеннях головного квантового числа n і тому проявляють подібні хімічні властивості.
Таким чином, при послідовному збільшенні зарядів атомних ядер періодично повторюється конфігурація електронних оболонок і, як наслідок, періодично повторюються хімічні властивості елементів. У цьому полягає фізичний зміст періодичного закону.
Елементи головних і побічних підгруп розрізняються своїми хімічними властивостями, проте їм притаманне і загальне, що об'єднує їх в одну групу - номер групи. Він, як правило, вказує на число електронів, яке може брати участь в утворенні хімічних зв'язків. У цьому полягає фізичний зміст номера групи.
Таким чином, у елементів головних підгруп валентними (тобто беруть участь в утворенні хімічних зв'язків) є електрони зовнішнього енергетичного рівня, а у елементів побічних підгруп - і електрони передостанніх рівнів. Це основна відмінність між елементами головних і побічних підгруп.
Оскільки електронна конфігурація атомів хімічних елементів змінюється періодично зі зростанням заряду їх ядер, все властивості, які визначаються електронною будовою, закономірно змінюється за періодами і групам періодичної системи. До таких властивостей відносяться перш за все різні хімічні і фізичні характеристики елементів: атомні та іонні радіуси, спорідненість до електрону, ступінь окислення, атомний об'єм і ін. Періодично змінюються також багато хімічні та фізичні властивості простих і складних речовин, утворених елементами-аналогами.
Атом не має строго певну межу, тому встановити його абсолютні розміри неможливо. Розрізняють такі радіуси атомів.
Ковалентний радіус є половиною меж'ядерного відстані в молекулах або кристалах відповідних простих речовин.
Металевий радіус дорівнює половині відстані між центрами двох сусідніх атомів кристалічної решітки металу.
Крім того, розрізняють іонні радіуси катіонів. які завжди менше атомних радіусів відповідних елементів, і радіуси аніонів. які більше атомних радіусів.
Орбітальний радіус - теоретично розраховане відстань від ядра до головного максимуму електронної площині головною орбіталі.
Закономірності зміни даних параметрів в системі елементів має періодичний характер. Найбільш загальні з них такі:
1. в періодах у міру зростання заряду ядер радіуси атомів зменшуються;
2. в групах із зростанням заряду ядер радіуси атомів збільшуються, при цьому в групах А таке збільшення відбувається в більшій мірі, ніж в групах В.
Хімічна активність елемента визначається здатністю його атомів втрачати або здобувати електрони. Кількісно це оцінюється енергією іонізації Еіон атомів (або потенціалом іонізації I) і його спорідненістю до електрона Еср.
Енергія іонізації - мінімальна енергія, необхідна для відриву найбільш слабозв'язаного електрона від збудженого атома (е - елемент):
Енергія іонізації виражається в килоджоулях на моль (кДж / моль) або в електрон-вольтах на атом (еВ / ат).
Найменша напруга електричного поля, при якому відбувається відрив електрона, називається потенціалом іонізації I (виражається в вольтах - В). Чисельне значення I в вольтах одно енергії іонізації Еіон. в електрон-вольтах.
Відриву першого електрона відповідає перший потенціал іонізації I1, другого - I2, і т.д. При цьому I1 Потенціал іонізації є складною функцією деяких властивостей атома: заряду ядра, радіуса атома, конфігурації зовнішніх електронних оболонок. Здатність атома утворювати негативно заряджені іони характеризується спорідненістю до електрону. під яким розуміється енергетіскій ефект приєднання електрона до нейтрального атома в процесі: Найбільшою спорідненістю до електрону характеризуються елементи групи VIIA. У більшості металів і благородних газів спорідненість до електрону невелика або навіть негативно. Приєднання двох або більшого числа електронів до атома взагалі неможливо. Електронегативність - умовна величина, що характеризує здатність атома в хімічній сполуці притягувати до себе електрони. Для практичної оцінки цієї здатності атома введена умовна відносна шкала електронегативності (ЕО). За такою шкалою найбільш електронегативний серед елементів, здатних утворювати хімічні сполуки, є фтор, а найменш електронегативним - францій. У періоді зі зростанням порядкового номера елемента ЕО зростає, а в групі, як правило - убуває.Схожі статті