Агрегатні стану рідких металів
Існує чотири основні стани речовини: рідке, тверде, газоподібне і плазма, з яких до ливарним процесів слід віднести два перших.
У звичайних умовах структура металу являє собою кристалічну решітку. Кристал розглядають як правильну сукупність атомів, які не обов'язково мають однакову природу. Всякий атом займає своє місце, яке визначається характером його геометричній взаємозв'язку з кристалічною решіткою і характеризує собою середнє положення центру цього атома (рисунок 1).
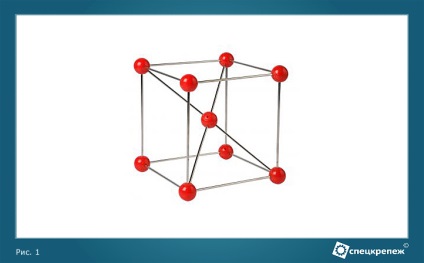
Малюнок 1 - Кристалічні ґрати заліза
Насправді атом здійснює теплові коливання в просторі між сусідніми атомами. При нагріванні в певний момент теплові коливання стають настільки сильними, що дальній порядок між атомами порушується і метал переходить в рідкий стан.
Рідкі метали, як і інші рідини, незначно перегріті над точкою початку кристалізації, набагато ближче за структурою та властивостями до твердого тіла, ніж до газів. На це вказує ряд факторів:
- При плавленні термодинамічні функції стану речовини (зміна ентальпії δ Н і зміна ентропії δ S) змінюються на порядок менше, ніж відповідні функції стану при сублімації (безпосередній перехід з твердого стану в газоподібний) або при випаровуванні (перехід з рідкого стану в газоподібний).
- Фізичні властивості при плавленні металів змінюються значно менше, ніж при сублімації або випаровуванні. Так, наприклад, питома обсяг більшості металів збільшується при плавленні на 5-10%, в той же час при випаровуванні він збільшується в тисячі разів. Тверді метали при температурі, близької до температури плавлення, мають деяку плинність, наприклад, при їх прокатці, а рідини характерні опірність зрушенню (або зрізу), але в звичайних умовах вона недостатньо помітна через високу плинність. Гази практично не чинять опір формозміни. Такі властивості як магнітна проникність, електропровідність, теплопровідність і ін. При плавленні металів хоча і змінюються, але лише на кілька відсотків.
- За допомогою рентгеноструктурних досліджень розплавлених легкоплавких металів, перегрітих над точкою ліквідусу лише на кілька градусів, встановлено, що частинки в рідинах розташовані не безладно. Їх розташування в рідини близько до того, яке характерно для твердого тіла поблизу його плавлення.
Сучасні теорії рідин в якійсь мірі об'єднують дві колишні крайні точки зору на природу рідин і враховують ті подвійні риси їхньої поведінки, які випливають з проміжного положення рідкого агрегатного стану речовини.
Металофізики, наприклад, Б.Чалмерс, вважають, що рідина є сукупність атомів і молекул, хто вагається з середньою енергією
3 kТ / 2 (К постійна Больцмана = 1,38. 10 - 23 Дж / град) і з середньою частотою ν. Всякий атом входить в ту чи іншу кристалоподібні освіту (кластер), які орієнтовані безладно. Частина простору між ними залишається незаповненою атомами. Кластери (малюнок 2) дуже швидко виникають і тут же розпадаються через перехід атомів від одного з них до іншого через вакансії - проміжні порожнечі. Імовірність появи і число мікрозародишей твердої фази визначаються законами статистичної фізики. У будь-який даний момент в рідини існує значний ближній порядок, коли всякий атом пов'язаний з якимось іншим і навіть з багатьма іншими сусідами точно так же, як це буває в кристалі.

Малюнок 2 - Кластер
Відповідно до теорії флуктуації в рідини спонтанно виникають локальні відхилення від її середньої концентрації, енергії і щільності, число і ймовірність яких диктуються законами статистичної механіки.
Для пояснення певних властивостей рідких розплавів використовується теорія Стюарта і Бенца, згідно з якою в рідинах безперервно руйнуються і створюються угруповання елементарних частинок, званих роями або сіботаксісамі. Ці угруповання є нестійкими утвореннями і не мають чітких меж розділу.
Згідно кластерної моделі Архарова і Новохатського розплав є поєднанням кластерів і разупорядоченной зони. Кластери характеризуються певною впорядкованістю будови центральної частини і нестабільністю периферійних частин. При підвищенні температури кластери розпадаються на більш дрібні, при охолодженні металу укрупнюються.
Основний сенс загальноприйнятою в даний час теорії Я.І. Френкеля полягає в тому, що перехід з твердого в рідкий стан обумовлений стрибкоподібним збільшенням кількості вакансій. Це викликає велику рухливість частинок і рідини в цілому, а також пояснює скачок розчинності багатьох речовин, при розплавленні розчинника. Необхідний надлишок енергії забезпечується флуктуаціями. Вакансії (дірки) мають розмір близько 10 -10 м. За Томпсону робота освіти сферичної порожнини в рідині радіусом r дорівнює:
Робота δZ порівнянна з теплотою випаровування. Важливим є той факт, що для перетворення рідини в кристалічний стан необхідно при температурі перетворення відвести тепло, відповідне прихованої теплоті плавлення. При цьому атоми переводяться в позиції з меншою потенційною енергією, ніж в рідині. Однак в обох випадках кожен атом має мінімальну вільну енергію, але в рідині ці мінімуми вище, ніж в кристалі.
У більшості випадків щільність розплаву менше, ніж у кристала. Кристали ж германію, кремнію, галію і вісмуту менш щільні своїх розплавів і пружні властивості забезпечуються виключно упорядкуванням атомів.
Є й інші теорії рідкого стану, але жодна з них не дозволяє за параметрами елементарних частинок рідини вирахувати її мікроскопічні властивості. Не дають вони пояснення багатьох явищ, які спостерігаються в рідини, наприклад, можливості значного переохолодження.
Подібність рідкого і кристалічного стану полягає, головним чином, в характері межчастичного взаємодії і в термодинамічних властивостях, але існує принципова відмінність в будові рідких і твердих тіл. Відома хаотичність в розташуванні частинок в рідині і велика їх рухливість, що ріднять рідина з газами, поєднуються з сильним міжчастинковою взаємодією, як і в твердому тілі. Цим поєднанням обумовлений комплекс властивостей, характерний тільки для рідкого стану речовини.
густина
За щільністю металу судять про розпушеності його структури. Щільність - одна з основних фізичних характеристик розплаву, безпосередньо пов'язана з поверхневий натяг, теплоємністю, динамічною в'язкістю, теплотамі розчинення і ін. Рідка фаза має лише трохи меншу щільність, ніж тверда речовина, але вона на кілька порядків вище щільності газу. Найлегший метал літій має щільність 0,53 г / см 3. а найважчий іридій щільністю 22,4 г / см 3. Щільність заліза 7,87 г / см 3. У більшості металів при нагріванні від кімнатної температури до температури плавлення щільність зменшується на 3-5%, у заліза вона знижується до 7,35 г / см 3. У процесі плавлення щільність більшості металів знижується на кілька%, у заліза - до 7,02 г / см 3. А щільність галію, вісмуту, сурми, германію та кремнію при плавленні збільшується, як у води, для якої це збільшення становить близько 11%.
При нагріванні рідких металів, як і в твердому стані, щільність зменшується. З достатньою для практики точністю використовується співвідношення:

Підбором складу сплавів забезпечують задану його щільність і коефіцієнт лінійного розширення. Це важливо, наприклад, для армованих (виконаних з різнорідних матеріалів) виробів, що служать при змінюються в широких межах температурах
Практичне значення зміни щільності металу до початку і в процесі кристалізації полягає в тому, що воно визначає об'ємну усадку (або зростання), з якою пов'язані усадочні раковини, рихлість, напруги в зовнішніх і внутрішніх ділянках злитків, заготовок та відливок (рисунок 3).
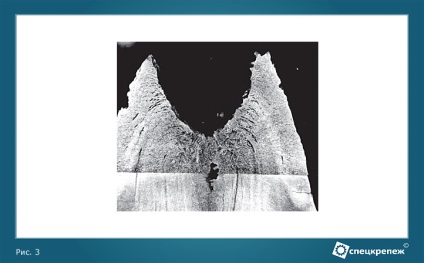
Малюнок 3 - Усадочна раковина в зливку
Температура плавлення - це єдина температура, при якій кристалічна тверда фаза співіснує в рівновазі з рідиною. Для чистого елемента або чистого з'єднання ця величина постійна і лише незначно залежить від тиску.
Зазвичай розливає метал перегрівається вище температури плавлення на 100 і більше градусів. Виходячи з цієї температури, вибирається матеріал ливарної форми і футерування розливних ковшів. З часто використовуваних металів ртуть має найнижчу температуру плавлення - мінус 39 0 С, а найвища вона у вольфраму - 3410 0 С. Чисте залізо плавиться при 1539 0 С, мідь - при 1 083 0 С, алюміній - при 660 0 С. Титанові сплави 1580-1720 0 С.
Сталь 1420-1520 0 С
Чавун 1150-1250 0 С
Бронзи 1000-1150 0 С
Латуні 900- 950 0 С
Алюмінієві сплави 580 630 0 С
Магнієві сплави 600- 650 0 С
Цинкові сплави 390- 420 0 С
Так як фазові перетворення супроводжуються тепловими ефектами, об'ємними змін і фазовими напруженнями, то їх враховують, задаючи оптимальні режими охолодження злитків, заготовок та відливок, а також при розгляді процесів структуроутворення і ліквації.
В'язкість металевого розплаву є найбільш характерним структурно-чутливим властивістю і визначається міжчастинковою взаємодією. Тому цей показник дозволяє оцінити будову розплаву, природу і сили взаємодії між компонентами в сплавах, а також зв'язок між твердим і рідким станом.
Для характеристики в'язкості рідини прийнятий коефіцієнт в'язкості або внутрішнього тертя. званий динамічною в'язкістю. Він чисельно дорівнює силі тертя між двома шарами з площею, що дорівнює одиниці при градієнті швидкості, що дорівнює одиниці.
У металів динамічна в'язкість підвищується зі збільшенням температури їх плавлення. Для всіх металів вона зменшується з підвищенням температури нагріву. У сплавів евтектичного складу зазвичай знижені значення в'язкості. Зміна в'язкості від складу сплавів змінюється неоднозначно, складним чином і залежить від сил межчастичного взаємодії. Забруднення розплавів зваженими частинками шлаку або оксидів супроводжується помітним зростанням в'язкості.
Порівняльні дані в'язкості (Па. С):
Вода (25 0 С) - 0,00089;
Сталь (1600 0 С) - 0,0050 - 0,0085;
Залізо (1600 0 С) - 0,0045 - 0,0050.
Поверхневий натяг чисельно дорівнює кількості вільної поверхневої енергії, що припадає на одиницю поверхні розділу між розглянутим речовиною і вакуумом. Поверхневий натяг стали обумовлює змочуваність і адгезію, впливає на характер струменя і ступінь вторинного окислення металу під час випуску з плавильного агрегату і розливання. У період кристалізації поверхневі явища впливають на поверхневі і об'ємні концентрації компонентів, суттєво змінюють структуроутворення, кінетику капілярного масопереносу, зародження, коагуляції і спливання неметалевих включень. Міжфазне натяг на межі метал-шлак в значній мірі визначає асиміляцію неметалічних включень, що утворюються при раскислении, обробці металу синтетичними шлаками і розливання під захисними середовищами.
Зі збільшенням температури плавлення металу поверхневий натяг, як правило, збільшується. Так, для ртуті, заліза і вольфраму воно відповідно дорівнює, Н / м: 0,45; 1,8 і 2,5. Перегрів рідкого металу на 100 0 С знижує поверхневий натяг приблизно на 2-4%.
Поверхнево активні добавки, які в металі - основі розчиняються в дуже малих кількостях і різко відрізняються від основи за своїми властивостями, істотно знижують поверхневий натяг розплавів. Так, 0,1% кисню знижує поверхневий натяг заліза до 1,1 Н / м, 0,1% калію знижує поверхневий натяг ртуті в 2 рази.
Властивості, що безпосередньо впливають на отримання злитків і виливків необхідної якості, називаються ливарними. Вони залежать від комплексу фізико-хімічних властивостей, що виявляються в утворюються фазах при охолодженні розплаву, але повністю ними не визначаються. До ливарним властивостям відносять вологотекучість і заповнюваність ливарних форм, усадку і пов'язані з нею процеси утворення різних дефектів, схильність до утворення дефектів на базі неметалевих і газових включень, активність взаємодії з навколишнім середовищем і контактирующими матеріалами, первинну і вторинну кристалізацію, ливарні напруги і тріщиностійкості, хімічну і структурну неоднорідність. Кращим поєднанням ливарних властивостей володіють сплави з великою кількістю евтектики. Ливарні властивості чавуну значно вище ливарних властивостей стали.