Будова вірусу імунодефіциту людини
Віріони ВІЛ мають вигляд сферичних частинок, діаметр яких становить близько 100-120 нанометрів (це приблизно в 60 разів менше діаметра еритроцита).
До складу зрілих віріонів входить кілька тисяч білкових молекул різних типів.
Всередині капсида знаходиться білково-нуклеїнових комплекс: дві нитки вірусної РНК, міцно пов'язані з білком нуклеокапсида p7, ферменти (зворотна транскриптаза, протеаза, інтеграли).
З капсидом також асоційовані білки Nef і Vif (7-20 молекул Vif на віріон).
Всередині віріона (і, найімовірніше, за межами капсида) виявлений білок Vpr8-11. Крім того, з капсидом ВІЛ-1 (але не ВІЛ-2) связазни близько 200 копій клітинного ферменту пептіділпролілізомерази, необхідного для складання віріона.
У ліпідну мембрану вбудовані 72 глікопротеїнових комплексу Env. кожен з яких утворений трьома молекулами трансмембранного глікопротеїну gp41 (TM), службовця «якорем» комплексу, і трьома молекулами поверхневого глікопротеїну gp120 (SU).
За допомогою білка gp120 вірус приєднується до рецептора CD4 і корецептор. знаходяться на поверхні Т-лімфоцитів людини. Стехіометричне співвідношення p24: gp120 в вирионе становить 60-100: 1.
Білки gp41 і особливо gp120 інтенсивно вивчаються в якості можливих мішеней для розробки ліків і вакцини проти ВІЛ.
При формуванні зовнішньої оболонки вірусу також відбувається захоплення певної кількості мембранних білків клітини, в тому числі людських лейкоцитарних антигенів (HLA) класів I і II і молекул адгезії.
Функції важливих структурних білків ВІЛ-1
Генетичний матеріал ВІЛ представлений двома копіями позитивно-смисловий (+) РНК. Геном ВІЛ-1 має довжиною 9000 нуклеотидів. Кінці генома представлені довгими кінцевими повторами (англ. Long terminal repeat, LTR), які керують продукцією нових вірусів і можуть активуватися і білками вірусу, і білками інфікованої клітини. 9 генів ВІЛ-1 кодують, по крайней мере, 15 білків.
Ген pol кодує ферменти: зворотний транскриптазу (RT), інтеграли (IN) і протеазу (PR).
Ген gag кодує поліпротеїнів Gag / p55, розщеплюється вірусної протеази до структурних білків p6, p7, p17, p24.
Ген env кодує білок gp160, розщеплюється клітинної ендопротеаз фурином на структурні білки gp41 і gp120.
Інші шість генів - tat, rev, nef, vif, vpr, vpu (vpx у ВІЛ-2) - кодують білки, що відповідають за здатність ВІЛ-1 інфікувати клітини і виробляти нові копії вірусу. Реплікація ВІЛ-1 in vitro можлива без генів nef, vif, vpr, vpu, проте їх продукти необхідні для повноцінної інфекції in vivo.
Gag: поліпротеїнів-попередник Gag / p55 синтезується з повнорозмірною геномної РНК (яка в даному випадку служить в якості мРНК) в процесі стандартної кеп-залежною трансляції, але можлива і IRES-залежна трансляція. Попередники функціональних білків розташовуються в складі поліпротеїну Gag / p55 в наступному порядку: p17 ... p24 ... p2 ... p7 ... p1 ... p6 (р1 і р2 - з'єднувальні пептиди; інші продукти розщеплення Gag / p55 описані вище).
Нерозщепленому протеазой Gag / p55 містить три основних домену: домен мембранної локалізації (М, membrane targeting), домен взаємодії (I, interaction) і «пізній» домен (L, late).
Домен М, розташований всередині області p17 / МА, мірістіліруется (приєднуються залишки миристиновой кислоти) і направляє Gag / p55 до плазматичної мембрани. Домен I, що знаходиться всередині області p7 / NC, відповідає за міжмолекулярні взаємодії окремих мономерів Gag / p55. Домен L, також локалізований в області p7 / NC, опосередковує отпочковиваніе віріонів від плазматичної мембрани; в цьому процесі бере участь також Р6 область поліпротеїну Gag / p55.
Vpu: Двома важливими функціями білка Vpu є:
1) руйнування клітинного рецептора CD4 в ЕПР шляхом залучення убіквітінлігазних комплексів і
2) стимуляція виділення дочірніх віріонів з клітини, шляхом інактивації інтерферон-індукованого трансмембранного білка CD317 / BST-2, що отримав також назву «tetherin» за його здатність пригнічувати виділення новоутворених дочірніх віріонів за допомогою їх утримання на поверхні клітини.
Vpr: Білок Vpr необхідний для реплікації вірусу в неделящихся клітинах, в тому числі макрофагах. Цей білок, поряд з іншими клітинними і вірусними білками, активує довгі кінцеві повтори генома ВІЛ. Білок Vpr грає важливу роль в перенесенні провируса в ядро і викликає затримку поділу клітини в періоді G2.
Vif: Білок Vif грає важливу роль в підтримці реплікації вірусу. Штами, позбавлені цього білка, що не реплицируются в CD4 + -лімфоцитів, деяких лініях T-лімфоцитів ( «недоступних клітинах») і макрофагах. Ці штами здатні проникати в клітини-мішені і починати зворотний транскрипцію, однак синтез провірусної ДНК залишається незавершеним.
Nef: Білок Nef виконує кілька функцій. Він пригнічує експресію молекул CD4 і HLA класів I і II на поверхні інфікованих клітин, і тим самим дозволяє вірусу вислизати від атаки цитотоксичних T-лімфоцитів і від розпізнавання CD4 + -лімфоцитів. Білок Nef може також пригнічувати активацію T-лімфоцитів, пов'язуючи різні білки-компоненти систем внутрішньоклітинної передачі сигналу.
У інфікованих вірусом імунодефіциту макак-резусів активна реплікація вірусу і прогресування хвороби можливі тільки при интактном гені nef. Делеції гена nef були виявлені в штамах ВІЛ, виділених у групи австралійців з тривалим непрогрессирующим перебігом інфекції.
Однак у частини з них з часом з'явилися ознаки прогресування інфекції, в тому числі зниження числа CD4 + -лімфоцитів. Таким чином, хоча делеции гена nef і можуть уповільнювати реплікацію вірусу, це не гарантує повної неможливості прогресування захворювання.
Tat і Rev: Регуляторні білки Tat (транс-активатор) і Rev накопичуються в ядрі клітини і пов'язують певні ділянки вірусної РНК. Білок Tat має молекулярну масу близько 14-15 кДа, пов'язує вторинну структуру геномної РНК поблизу 5'-нетрансльовані області активує зворотний транскрипцію геномної РНК ВІЛ, синтез вірусних мРНК, необхідний для реплікації вірусу майже у всіх культурах клітин, регулює вихід віріонів із заражених клітин, потребує клітинному кофакторами - цикліни T1. Білок Rev регулює експресію білків віріона, пов'язує мРНК гена env в області RRE (англ. Rev response element) інтрона, обробити Екзони генів Tat і Rev.
Білки Tat і Rev стимулюють транскрипцію провірусної ДНК і транспорт РНК з ядра в цитоплазму, а також необхідні для трансляції. Білок Rev забезпечує також транспорт компонентів вірусу з ядра і перемикання синтезу регуляторних білків вірусу на синтез структурних.
На схемі показано злиття вірріона ВІЛ і плазматичноїмембрани Т-лімфоцити людини
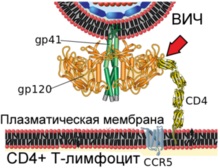
Етап 1. Взаємодія вірусного білка gp120 з клітинним рецептором CD4 (вказано червоною стрілкою)
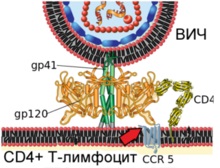
Етап 2. Конформаційні зміни вірусного білка gp120 забезпечують зв'язування з клітинним рецептором CCR5 (вказано червоною стрілкою)
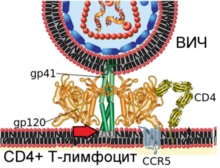
Етап 3. Кінцеві ділянки вірусного білка gp41 проникають в плазматичну мембрану клітини (вказано червоною стрілкою)
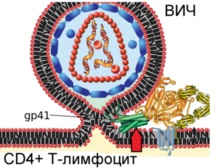
Етап 4. Вірусний білок gp41 зазнає значних конформаційних змін, складається навпіл (вказано червоною стрілкою) і утворює спіраль, що призводить до зближення і злиття мембран віріона і клітини. Таким чином ВІЛ захоплює Т-лімфоцит з метою подальшої репродукції.
Проникнення в клітину і інтеграція
Вірусна інфекція починається, коли віріон ВІЛ стикається з людською кліткою, що має на своїй мембрані рецептор CD4. Вірусний глікопротеїн gp120 міцно пов'язує рецептор CD4. В результаті такої взаємодії gp120 зазнає конформаційні зміни, які дозволяють йому також зв'язати молекулу корецептора CXCR4 або CCR5 (експрессіруемих на поверхні Т-лімфоцитів, макрофагів, дендритних клітин і мікроглії).
Залежно від здатності зв'язувати ці корецептор, ВІЛ класифікують на R5-тропний (пов'язують тільки CCR5), X4-тропний (пов'язують тільки CXCR4) і R5X4-тропний (можуть взаємодіяти з обома корецептор). Препарати, що блокують корецептор можуть бути ефективні проти ВІЛ.
Після описаних подій мембрана клітини і мембрана віріона ВІЛ зливаються, і вміст віріона проникає всередину клітини. Білок gp41 дуже важливий для злиття мембран, тому його розглядають як мішень для розробки противірусних препаратів. Усередині клітини вірусна РНК вивільняється з капсида, і відбувається зворотна транскрипція - синтез ДНК на основі матриці одноцепочечной геномної РНК вірусу, катализируемая зворотного транскриптазой.
Велика частина лікарських препаратів, схвалених для застосування при ВІЛ-інфекції, спрямована на порушення роботи зворотного траскріптази. Синтезована ДНК транспортується всередину ядра клітини і вбудовується в хромосому хазяїна під дією інтеграли. Кілька препаратів, що пригнічують інтеграли, проходять ранні стадії клінічних випробувань. Вірусна ДНК, вбудувати в хромосому клітини, називається провіруси.
Людська РНК-полімераза в ядрі клітини синтезує інформаційну РНК (мРНК), а пізніше і геномної РНК вірусу. Синтезовані РНК транспортуються назад в цитоплазму, де на матриці мРНК на рибосомах синтезуються вірусні ферменти, структурні і регуляторні білки.
Збірка і отпочковиваніе віріонів
Геномна РНК вірусу, а також вірусні білки транспортуються до місць складання віріонів. Збірка віріонів відбувається на мембрані, куди направляється мірістілірованний поліпротеїнів Gag / p55. Віріони спочатку формуються з поліпротеїнів-попередників структурних білків і ферментів і на цій стадії не є інфекційними.
В ході дозрівання вірусної частинки вірусна протеаза розщеплює білки-попередники до функціональних компонентів. Кілька схвалених противірусних препаратів пригнічують роботу протеази і перешкоджають формуванню зрілих віріонів.
Нові вірусні частки відокремлюються від поверхні клітини, захоплюючи частину її мембрани, і виходять у кров'яне русло, а клітина господаря, несуча рецептор CD4, гине. Недавні дослідження показали, що процес отпочковиванія віріонів може бути більш складним, ніж вважалося раніше. Так було виявлено, що завдяки взаємодії білка Gag з компонентами клітини віріони накопичуються в особливих внутрішньоклітинних мультивезикулярні тільцях, які зазвичай служать для експорту білків. Таким чином вірусні частки вивільняються з клітки, експлуатуючи її власну систему транспорту макромолекул.
Поширення по організму
У період гострої фази ВІЛ-інфекції відсутність специфічної імунної відповіді дозволяє вірусу активно реплицироваться і досягати високих концентрацій в крові.
Вірус заселяє органи лімфатичної системи, CD4 + лімфоцити, CD8 + лімфоцити і макрофаги, а також інші клітини: альвеолярнімакрофаги легких, клітини Лангерганса, фолікулярні дендритні клітини лімфатичних вузлів, клітини олігодендроглії і астроцити мозку і епітеліальні клітини кишки.
У лімфоїдної тканини ВІЛ розмножується протягом усього захворювання, вражаючи макрофаги, активовані і покояться CD4 + лімфоцити і фолікулярні дендритні клітини. Кількість клітин, що містять провірусну ДНК, в лімфоїдної тканини в 5-10 разів вище, ніж серед клітин крові, а реплікація ВІЛ в лімфоїдної тканини на 1-2 порядки вище, ніж в крові.
Резервуаром ВІЛ служать лімфатичні вузли і конкретно дендрітниe клітини, в яких вірус зберігається тривалий час після періоду гострої віремії.
Для активації CD8 + -лімфоцитів і освіти антиген-специфічних цитотоксичних T-лімфоцитів необхідна презентація пептидного антигену в комплексі з людськими лейкоцитарними антигеном класу I.
Дендритні клітини, необходімиe для початку первинних антиген-специфічних реакцій, захоплюють антигени, переробляють і переносять їх на свою поверхню, де ці антигени в комплексі з додатковими стимулюючими молекулами активують T-лімфоцити.
Заражені клітини часто не виділяють додаткових стимулюючих молекул і тому не здатні викликати активацію достатнього числа B і T-лімфоцитів, функція яких залежить від дендритних клітин.
Після завершення зворотної транскрипції в CD4 + -лімфоціте вірусний геном представлений провирусной Не вбудована ДНК. Для вбудовування провірусної ДНК в геном клітини-господаря і для утворення нових вірусів необхідна активація T-лімфоцитів.
Контакт CD4 + -лімфоцитів і антігенпредставляющіх клітин в лімфоїдної тканини, наявність вірусів на поверхні фолікулярних дендритних клітин і присутність прозапальних цитокінів (ІЛ-1, ІЛ-6 і ФНО) сприяють розмноженню ВІЛ в інфікованих клітинах. Саме тому лімфоїдна тканина служить самої сприятливим середовищем для реплікації ВІЛ.
Крім того, цей метод виявився також ефективним для профілактики зараження неінфікованих клітин. Описаний підхід може привести до розробки способу повного позбавлення від ВІЛ-інфекції.