Лімфатична система людини виконує ряд важливих захисних функцій, які попереджають розвиток патогенних мікроорганізмів або вірусів в рідких середовищах, клітинах і тканинах. За гуморальний імунітет відповідають В-лімфоцити, які при подальшому дозріванні синтезують імуноглобуліни (Ig). Будова цих речовин дозволяє знаходити, позначати і знищувати що прийшли в організм антигени. У чому полягають особливості молекул?
плазматичні клітини
Всі лімфатичні клітини організму людини діляться на дві великі групи: Т-лімфоцити і В-лімфоцити. Перші відповідають за клітинний імунітет, поглинаючи антигени в процесі фагоцитозу. Завдання друге полягає в синтезі специфічних антитіл - гуморальний імунітет.
В-лімфоцити детермінуються у вторинних лімфоїдних органах (лімфатичні вузли, селезінка), а потім формують популяцію плазмоцитов, які також називаються плазматичними клітинами. Вони надалі мігрують в червоний кістковий мозок, слизові оболонки і тканини.
Плазмоцити досягають великих розмірів (до 20 мкм), фарбуються базофильно, т. Е. В фіолетовий колір за допомогою барвників. У центрі цих клітин знаходиться велике ядро з характерними грудочки гетерохроматину, які нагадують спиці колеса.
Цитоплазма забарвлюється світліше, ніж ядро. У ній розташовується потужний транспортний центр, що складається з ендоплазматичної мережі і апарату Гольджі. АГ розвинений досить сильно, формуючи так званий світлий дворик клітини.
Всі перераховані структури спрямовані на синтез антитіл, які відповідають за гуморальний імунітет. Будова молекули імуноглобуліну має свої особливості, тому важливо поступове і якісне дозрівання цих структур в процесі синтезу.
Власне, для цього і розвинена така густа мережа ЕРС і апарату Гольджі. Також генетичний апарат плазмоцитов, укладений в ядрі, спрямований переважно на синтез білків антитіл. Зрілі плазматичні клітини є прикладом високого ступеня детермінації, тому рідко діляться.
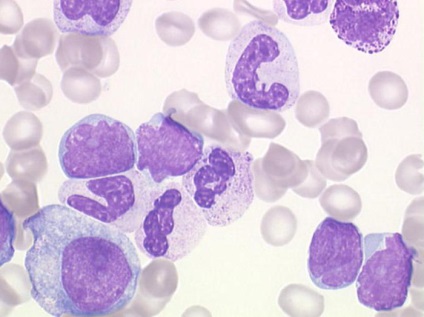
Будова антитіл імуноглобуліну
Ці високо спеціалізовані молекули є гликопротеидами, т. К. Мають білкову та вуглеводну частини. Нас цікавить скелет імуноглобулінів.
Молекула складається з 4 пептидних ланцюгів: дві важкі (Н-ланцюги) і дві легкі (L-ланцюга). Вони з'єднуються один з одним за допомогою дисульфідних зв'язків, і в результаті ми можемо спостерігати форму молекули, нагадує рогатку.
Будова імуноглобулінів направлено на з'єднання з антигенами за допомогою специфічних Fab-фрагментів. На вільних кінцях "рогатки" кожна така ділянка утворений двома варіабельними доменами: одним від важкої і одним від легкого ланцюга. Каркасом служать постійні домени (по 3 на кожній тяжкій і по одному на легких ланцюгах).
Рухливість варіабельних решт імуноглобуліну забезпечується наявністю шарнірного ділянки в місці, де формується дисульфідний зв'язок між двома Н-ланцюгами. Так набагато спрощується процес взаємодії антиген-антитіло.
Залишається нерозглянутим третій кінець молекули, який не взаємодіє з чужорідними молекулами. Він називається Fc-ділянкою та відповідає за прикріплення імуноглобуліну до мембран плазмоцитов і інших клітин. До речі, легкі ланцюги можуть бути двох видів: каппа (κ) і лямбда (λ). Вони з'єднані між собою дисульфідними связямі.Также є п'ять видів важких ланцюгів, за якими класифікують різні типи імуноглобулінів. Це α- (альфа), δ- (дельта), ε- (епсилон), γ- (гамма) μ- (мю) ланцюга.
Деякі антитіла здатні утворювати полімерні структури, які стабілізуються за рахунок додаткових J-пептидів. Так утворюються димери, тримери, тетрамери або пентомери Ig певного типу.
Ще одна додаткова S-ланцюг характерна для секреторних імуноглобулінів, будова і біохімія яких дозволяють їм функціонувати в слизових оболонках порожнини рота або кишечника. Ця додаткова ланцюг запобігає руйнуванню молекул антитіл природними ферментами.
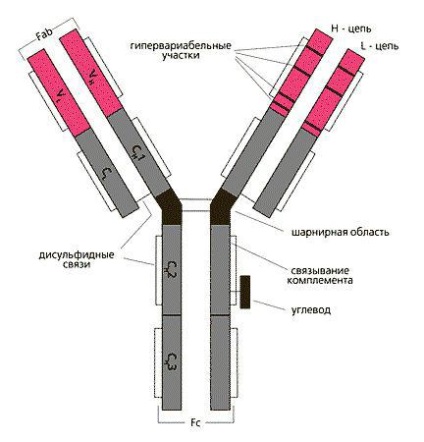
Будова і класи імуноглобулінів
Різноманітність антитіл в нашому організмі зумовлює варіабельність функцій гуморального імунітету. Кожен клас Ig має свої відмінні характеристики, за якими неважко здогадатися про їхню роль в імунній системі.
Будова і функції імуноглобулінів безпосередньо залежать один від одного. На молекулярному рівні вони відрізняються амінокислотною послідовністю важкого ланцюга, типи якої ми вже згадали. Отже, виділяють 5 видів імуноглобулінів: IgG, IgA, IgE, IgM і IgD.
Особливості імуноглобуліну G
IgG не утворює полімери і не вбудовується в мембрани клітин. У складі молекул виявлено присутність гамма-важкого ланцюга.
Відмінною рисою цього класу є той факт, що тільки дані антитіла здатні проникати через плацентарний бар'єр і формувати імунний захист зародка.
Будова імуноглобуліну G дозволяє виконувати наступні функції:
- Нейтралізація токсинів.
- Опсонізація антигенів.
- Запуск комплемент-опосередкованого цитолізу.
- Презентація антигену клітин-кілерів.
- Забезпечення імунітету новонародженого.
Імуноглобулін А: особливості та функції
Цей клас антитіл зустрічається в двох формах: сироваткової і секреторною.
У сироватці крові IgA становить 10-15% всіх антитіл, а його середня кількість становить 2,5 г / л до 10-річного віку.
Більше нас цікавить секреторна форма імуноглобуліну А, т. К. Близько 60% молекул даного класу антитіл зосереджені в слизових оболонках організму.
Будова імуноглобуліну А також відрізняється своєю варіативністю за рахунок наявності J-пептиду, який може брати участь в утворенні димарів, тримерів або тетрамеров. За рахунок цього один такий комплекс антитіл здатний зв'язувати велику кількість антигенів.
Під час утворення IgA до молекули приєднується ще один компонент - S-білок. Його головним завданням є захист всього комплексу від руйнівної дії ферментів і інших клітин лімфатичної системи людини.
Імуноглобулін А міститься в слизових оболонках шлунково-кишкового тракту, сечостатевої системи і дихальних шляхів. Молекули IgA обволікають антигенні частки, тим самим перешкоджаючи їх адгезії на стінках порожнистих органів.
Функції цього класу антитіл наступні:
- Нейтралізація антигенів.
- Є першим бар'єром серед всіх молекул гуморального імунітету.
- Опсонірующіх і маркують антигени.
імуноглобулін М
Представники класу IgM виділяються великими розмірами молекули, т. К. Їх комплекси є пентамер. Всю конструкцію підтримує J-білок, а каркасом молекули є важкі ланцюги ню-типу.
Пентамерная структура характерна для секреторною форми цього імуноглобуліну, однак існують і мономери. Останні кріпляться до мембран В-лімфоцитів, тим самим допомагаючи клітинам виявляти патогенні елементи в рідинах організму.
Кількість антитіл М підвищується у новонароджених, тому що це є фактором інтенсивної секреції IgG. Така стимуляція позитивно впливає на розвиток імунітету немовляти.
Будова імуноглобуліну М не дозволяє проникати через плацентарні бар'єри, тому виявлення цих антитіл в рідинах плода стає сигналом про порушення обмінних механізмів, інфекції або дефекті плаценти.
- Нейтралізація.
- Опсонізація.
- Активація комплемент-залежного цитолізу.
- Формування імунітету новонародженого.

Особливості імуноглобуліну D
Даний вид антитіл вивчений досить мало, тому їх роль в організмі до кінця не з'ясована. Зустрічаються IgD тільки у вигляді мономерів, в сироватці крові ці молекули становлять не більше 0,2% від усіх антитіл (0,03 г / л).
Основна функція імуноглобуліну D - це рецепція в складі мембрани В-лімфоцитів, однак тільки 15% всієї популяції цих клітин мають IgD. Прикріплюються антитіла за допомогою Fc-кінця молекули, а важкі ланцюги відносяться до дельта-класу.
Будова і функції імуноглобуліну Е
Цей клас становить незначну частку всіх антитіл сироватки крові (0,00025%). IgE, він же реагіни, мають високу цітофільностью: мономери цих імуноглобулінів прикріплюються до мембран огрядних кліток і базофілів. В результаті IgE впливає на вироблення гістаміну, який призводить до розвитку запальних реакцій.
У будові імуноглобуліну Е присутні важкі ланцюги епсилон- типу.
Будова імуноглобулінів безпосередньо впливає на їх функції в організмі. Гуморальний імунітет відіграє велику роль у підтримці гомеостазу, тому всі антитіла повинні працювати чітко і злагоджено.

Ви навіть не здогадувалися, як можна використовувати дитячі вологі серветки Ви звикли використовувати дитячі вологі серветки виключно за призначенням? Запевняємо вас, що ви безнадійно відстали від життя. Насправді, застосований.

