В даний час освіту і властивості комплексних сполук пояснюють з точки зору теорії методу валентних зв'язків (ВС), теорії кристалічного поля (ТКП) та теорії молекулярних орбіталей (МО).
Далі коротко на прикладах розглянемо кожну з теорій.
Теорія методу валентних зв'язків
Теорія ВС розглядає утворення комплексних іонів як донорно-акцепторна взаємодія неподіленого електронних пар лиганда і вільних орбіталей комплексоутворювача.
Розглянемо комплексний іон [Co (NH3) 6] 3+
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 6 4p 0 4d 0
Відповідно до правила Хунда електрони на зовнішньому енергетичному рівні розташовуються в такий спосіб:
Комплексоутворювач має координаційне число к.ч. = 6, тому може приєднати 6 лігандів, кожен з яких має неподеленную електронну пару і є, таким чином, донором електронів. Акцептор (комплексоутворювач) для розміщення шести електронних пар повинен надати шість вакантних орбіталей. При утворенні комплексної іона [Co (NH3) 6] 3+ чотири неспарених електрона в d - стані Co 3+ спочатку утворюють електронні пари, в результаті чого дві 3d-орбіталі звільняються:
Потім утворюється сам комплексний іон [Co (NH3) 6] 3+. має наступну будову:
В освіті цього комплексного іона беруть участь внутрішні 3d-орбіталі і зовнішні 4s- і 4p-орбіталі. Тип гібридизації - d2sp3.
Наявність тільки спарених електронів говорить про діамагнітних властивостях іона.
Теорія кристалічного поля
Теорія кристалічного поля ґрунтується на припущенні, що зв'язок між комплексоутворювачем і лігандами частково іонна. Однак береться до уваги вплив електростатичного поля лігандів на енергетичний стан електронів центрального іона.
K2 [Zn (CN) 4] - має тетраедричних просторову структуру (sp3 - гібридизація)
K3 [Fe (CN) 6] - має октаедричні просторову структуру (sp3d2 гібридизація)
Комплексообразователи мають наступну електронну конфігурацію:
d - електрони одного і того ж енергетичного рівня однакові в разі вільного атома або іона. Але дія електростатичного поля лігандів сприяє розщепленню енергетичних рівнів d - орбіталей в центральному іоні. І розщеплення тим більше (при одному і тому ж комплексообразователи), чим сильніше поле, створюване лигандами. За свою здатність викликати розщеплення енергетичних рівнів ліганди розташовуються в ряд:
CN -> NO2 -> NH3> SCN -> H2 O> OH -> F -> Cl -> Br -> I -
Будова комплексного іона впливає на характер розщеплення енергетичних рівнів комплексообразователя.
При октаедричному будові комплексного іона, dγ орбіталі (dz 2 -, dx 2 -y 2 орбіталі) піддаються сильному взаємодії поля лігандів. і електрони цих орбіталей можуть мати велику енергію, ніж електрони dε орбіталі (dxy. dxz, dyz - орбіталі).
Розщеплення енергетичних рівнів для електронів в d-стані в октаедричному поле лігандів можна представити у вигляді схеми:
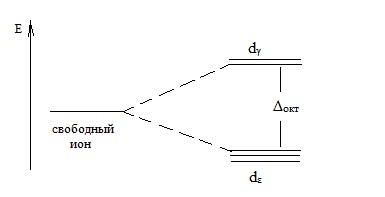
Тут Δокт - енергія розщеплення в октаедричному поле лігандів.
При тетраедричних структурі комплексного іона dγ орбіталі мають більш низькою енергією, ніж dε орбіталі:
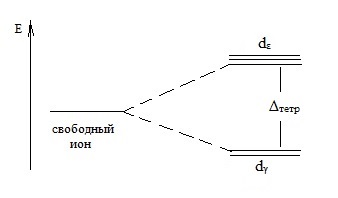
Тут Δтетр - енергія розщеплення в тетраедричних поле лігандів.
Енергію розщеплення Δ визначають експериментально за спектрами поглинання речовиною квантів світла, енергія яких дорівнює енергії відповідних електронних переходів. Спектр поглинання, а також і забарвлення комплексних сполук d-елементів, обумовлені переходом електронів з d-орбіталі нижчої енергії на d-орбіталь з більш високою енергією.
Так, в разі солі K3 [Fe (CN) 6], при поглинанні кванта світла, можливий перехід електрона з dε орбіталі на dγ орбіталь. Цим пояснюється, що дана сіль має оранжево-червоне забарвлення. А сіль K2 [Zn (CN) 4] не може поглинати світло і, внаслідок цього, вона безбарвна. Це пояснюється тим, що перехід електронів з dγ орбіталі на dε орбіталь неможливий.
Теорія молекулярних орбіталей
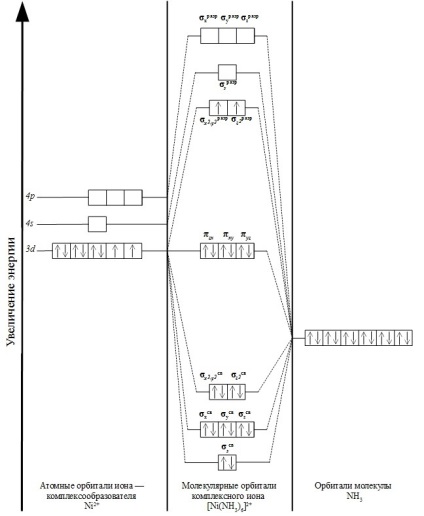
За допомогою цього методу покажемо електронну конфігурацію високоспінового комплексного іона [Ni (NH3) 6] 2+.
Електронна конфігурація іона Ni 2+:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 8 4p 0 4d 0 або ... 4s 0 3d 8 4p 0 4d 0
У комплексному іоні [Ni (NH3) 6] 2+ в утворенні хімічного зв'язку беруть участь 8 електронів центрального іона Ni 2+ і 12 електронів шести лігандів NH3.
Комплексний іон має октаедричні будова. Освіта МО можливо тільки в тому випадку, коли енергії вихідних взаємодіючих частинок близькі за своїми значеннями, а також орієнтовані в просторі відповідним чином.
У нашому випадку, орбиталь 4s іона Ni 2+ рівноцінно перекривається з орбиталями кожного з шести лігандів. В результаті цього утворюються молекулярні орбіталі: зв'язує σs св і розпушуються σs разр.
Перекриття трьох 4p-орбіталей комплексоутворювача з орбиталями лігандів призводить до утворення шести σp-орбіталей: зв'язують σх св. σy св. σz св і розпушують σх разр. σy разр. σz разр.
Перекриття dz 2 і dx 2 -y 2 комплексообразователя з орбиталями лигандов сприяє утворенню чотирьох молекулярних орбіталей: двох зв'язують σ св х 2 -y 2. σ св z 2 і двох розпушуючих σ разр х 2 - y 2. σ разр z 2.
Орбіталі dxy. dxz, dyz іона Ni 2 + не зв'язуються з орбиталями лігандів, тому що не спрямовані до них. Внаслідок цього, вони не беруть участі в утворенні σ-зв'язку, і є несвязивающімі орбиталями: πxz. πxy. πyz.
Разом, комплексний іон [Ni (NH3) 6] 2+ містить 15 молекулярних орбіталей. Розташування електронів можна зобразити таким чином:
Схематично освіту молекулярних орбіталей зображено на діаграмі нижче: