Дипольниммоментом електричний, векторна величина, що характеризує асиметрію розподілу покладе. і отрицат. зарядів в електрично нейтральної системі. Два однакових за величиною заряду + q і -q утворюють електричні. диполь з Д. м. m = q l, де l - відстань між зарядами. Для системи з п зарядів qi радіуси-вектори яких брало ri. У молекулах і мол. системах центри покладе. зарядів Q а збігаються з положеннями атомних ядер (радіуси-вектори rA), а електронний розподіл описується щільністю ймовірності r (r). В цьому випадку Д. м. Вектор Д. м. Направлений від центра ваги отрицат. зарядів до центру тяжіння позитивних. У хім. літературі Д. м. молекули іноді приписують протилежний зміст. Часто вводять уявлення про Д. м. Окремих хім. зв'язків, векторна сума яких брало дає Д. м. молекули. При цьому Д. м. Зв'язку визначають двома покладе. зарядами ядер атомів, що утворюють зв'язок, і розподілом отрицат. (Електронного) заряду. Д. м. Хім. зв'язку обумовлений зміщенням електронної хмари в бік одного з атомів. Зв'язок зв. полярної, якщо відповідний Д. м. істотно відрізняється від нуля. Можливі випадки, коли окремі зв'язку в молекулі полярні, а сумарний Д. м. Молекули дорівнює нулю; такі молекули зв. неполярними (напр. молекули СО2 і CCl4). Якщо ж Д. м. Молекули відмінний від нуля, молекула зв. полярної. Напр. молекула Н2 Про полярна; підсумовування Д. м. двох полярних зв'язків ОН також дає відмінний від нуля Д. м. спрямований по бісектрисі валентного кута НОН. Порядок величини Д. м. Молекули визначається твором заряду електрона (1,6. 10 - 19 Кл) на довжину хім. зв'язку (близько 10 - 10 м), т. е. становить 10 - 29 Кл. м. У довідковій літературі Д. м. молекул призводять в Деба (Д або D), на ім'я П. Дебая; 1 Д = 3,33564. 10 - 30 Кл. м. Спектроскопіч. методи визначення Д. м. молекул засновані на ефектах розщеплення і зсуву спектральних ліній в електричні. поле (ефект Штарка). Для лінійних молекул і молекул типу симетричного дзиги відомі точні вирази, що зв'язують Д. м. З штарковскім розщепленням ліній обертальних спектрів. Цей метод дає наиб. точні значення величини Д. м. (до 10 - 4 Д), причому експериментально визначається не тільки величина, але і напрямок вектора Д. м. Важливо, що точність визначення Д. м. майже не залежить від його абс. величини. Це дозволило отримати досить точні значення дуже малих Д. м. Ряду молекул вуглеводнів, к-які не можна надійно визначити ін. Методами. Так, Д. м. Пропану дорівнює 0,085 b 0,001 Д, пропілену 0,364 b 0,002 Д, пропіну 0,780 b 0,001 Д, толуолу 0,375 b 0,01 Д, азулена 0,796 b 0,01 Д. Область застосування методу мікрохвильової спектроскопії обмежена, однак, невеликими молекулами, що не містять атомів важких елементів. Напрямок вектора Д. м. Молекули м. Б. визначено експериментально і по Зеемана ефекту другого порядку. Др. група методів визначення Д. м. заснована на вимірах діелектричної. проникності е в-ва. Цими методами виміряні Д. м. Молекул більше 10 тис. В-в. Перехід від вимірюваного значення e газу, чистої рідини або розбавляючи. р-ра, т. е. макроскопіч. характеристики діелектрика, до величини Д. м. заснований на теорії поляризації діелектриків. Вважається, що при накладенні електричні. поля на діелектрик його повна поляризація Р (середній Д. м. одиниці об'єму) складається з наведеної, або індукованої, поляризації Рм і орієнтаційної поляризації Рор і пов'язана з m рівнянням Ланжевена - Дебая:
де М - мовляв. маса, d - щільність, a - поляризованість молекули, NA - число Авогадро, k - постійна Больцмана, Т - абс. т-ра. Вимірювання діелектричної. проникності проводять в постійному полі або при низьких частотах, які забезпечують повну орієнтацію молекул по полю. При наиб. поширеному варіанті методу - вимірах в розбавляючи. розчинах неполярних р-телеглядачам - передбачається адитивність поляризаций розчиненого в-ва і р-розчинника. Зіставлення Д. м. Полярних молекул деяких орг. соед. отриманих різними методами, показано в таблиці.
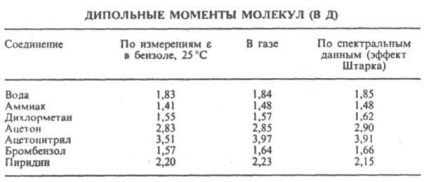
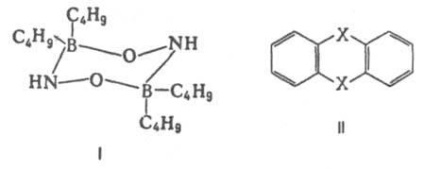
Найважливіша область застосування даних про Д. м. Молекул -структурние дослідження, встановлення конформації молекул, конформационного і ізомерного складу в-ва, його залежності від т-ри. Величини Д. м. Молекул дозволяють судити про розподіл електронної щільності в молекулах і залежності цього розподілу від характеру окремих заступників. У загальному випадку структурна інтерпретація Д. м. Вимагає порівняння експери. величин зі значеннями, отриманими квантовомех. розрахунком або за допомогою адитивної векторної схеми з використанням Д. м. окремих зв'язків і атомних груп. Останні знаходять або по интенсивностям колебат. смуг поглинання, або шляхом векторного розкладання Д. м. деяких симетричних молекул. Розрахунки з використанням векторної адитивної схеми можуть враховувати разл. прояви стереохім. нежорсткості, напр. утруднене або своб. внутр. обертання молекули. Високосімметрічние мовляв. структури, що володіють центром інверсії, двома взаємно перпендикулярними осями обертання або осями, перпендикулярними площині симетрії, не повинні мати Д. м. За наявністю або відсутністю Д. м. молекули можна в окремих випадках вибрати для неї ту чи іншу структуру без к.-л . теоретич. розрахунків. Так, рівність нулю т фіз. Д. м. Димера амінооксідібутілборана (ф-ла I) є доказом того, що він існує у вигляді стійкої кресловідной конформації, що володіє центром інверсії. Навпаки, наявність Д. м. У тіантрена (ф-ла II, X = S) і селенантрена (II, X = Se), рівних 1,57 Д і 1,41 Д соотв. виключає для них центросімметрічни структуру, зокрема плоску.
===
Ісп. література для статті «дипольниммоментом»: Мінкін В. І. Осипов О. А. Жданов Ю. А. Дипольні моменти в органічній хімії. Л. 1968; Осипов О. А. Мінкін В. І. Гарновскій А. Д. Довідник по дипольним моментам, 3 вид. М. 1971; Exner О. Dipole moments in organic chemistry, Stuttg. 1975. В. І. Muнкін.
Сторінка «дипольниммоментом» підготовлена за матеріалами хімічної енциклопедії.