Нижче - пояснення читачам, щоб було ясніше, через що у електрохімічної науки існує необхідність в підвищенні енергоефективності.
Отже, електроліз води, тобто розкладання її на водень і кисень (1):
(1)
З огляду на, що це ендотермічний процес, тобто протікає з поглинанням енергії, встає питання про його економічному сенсі. Він, правда, не в моїй компетенції, але можу припустити, що сенс може бути, наприклад, в тому, щоб використовувати водень для зберігання енергії.
Вихід по току залежить від безлічі факторів: складу і температури електроліту, матеріалу і стану електродів, сили струму і напруги. Варіюючи в певних межах ці параметри, можна оптимізувати витрати енергії на цільової електрохімічний процес.
Саме ж протікання побічних реакцій пов'язано з їх термодинамічної можливістю (див. Нижче) і ненульовий швидкістю (див. Нижче).
2) Знос електродів - це матеріальні, а не енергетичні втрати. Однак для виготовлення електродів теж необхідно витрачати енергію, тому я включив цей пункт. Найчастіше зношуються аноди - на них протікають процеси окислення. Катоди теж можуть руйнуватися, якщо електроліт досить агресивний.
Стійкість анода є функція від його складу і структури, а також щільності струму.
3) Найбільш складно для розуміння третій явище - перенапруження. Спробую пояснити його суть.
Щоб стало можливим електроліз, необхідно подати на катод і анод певну різницю потенціалів. Мінімально необхідна різниця потенціалів вважається за допомогою рівняння Нернста (5):
, (5)
де
E - електродний потенціал полуреакции, В;
E ° - електродний потенціал полуреакции, В;
R - газова постійна, 8,314 Дж / (моль × К);
T - температура, К;
n - число електронів, що бере участь в полуреакции;
F - постійна Фарадея, 96500 Кл / моль.
- твір активностей (фугітівності) окислених форм;
- твір активностей (фугітівності) відновлених форм.
Так, електродний потенціал полуреакции (4) запишеться у вигляді (6):
(6)
Ось приклад.
При розкладанні води (в кислих розчинах) на аноді йде окислення її до кисню:
EА ° = 1,36 В
На катоді йде відновлення її до водню:
Eк ° = 0 В
Мінімальна різниця потенціалів (ΔE), яку треба подати на електроди, щоб почав протікати електроліз, складе ΔE = EА - Eк. У разі води це значення при стандартних умовах (активність іонів водню 1, тиск, для особливо допитливих - фугітівность, кисню і водню 1 атм, тоді другий член рівняння Нернста дорівнює 0 і E = E °) складе 1,36 В. Однак в реальності це напруга часто більше на величину, яка називається перенапругою Δφ, яке, до того ж, залежить від щільності струму на даному електроді Δφ = f (j), матеріалу електрода і стану його поверхні.
Звідки береться перенапруження?
Причини виникнення перенапруги - кінетичні, тобто пов'язані зі швидкістю протікання електрохімічної реакції.
Розглянемо реакцію, зворотний електролізу води: вибух гримучого газу, тобто суміші 2 обсягів водню і 1 обсягу кисню. Реакція супроводжується виділенням великої кількості теплоти, однак при кімнатній температурі не протікає через високу енергії активації (позначено EА на малюнку нижче) - потенційного бар'єру, якого треба подолати міцним молекулам водню і кисню. Щоб вибух все-таки стався, суміш необхідно підпалити, тобто нагріти, підвищивши потенційну енергію частини молекул. Можна внести каталізатор, наприклад, мелкораздробленного платину, яка знизить енергію активації.
Перенапруження - це електрохімічний еквівалент енергії активації, вона відображає ті додаткові (в порівнянні з термодинамічними, розрахованими за рівнянням Нернста) енергетичні витрати, які треба подолати для того, щоб швидкість електролізу була висока.
У перенапруги є кілька складових.
У процесі електролізу приелектродному шар збіднюється тими іонами, які розряджаються на відповідному електроді. Таким чином, значення концентрацій, які треба підставляти в рівняння Нернста, не відповідають тим, які спостерігаються в обсязі електроліту, а, значить, і різниця потенціалів, при якій буде тривати електроліз, збільшиться. Таке перенапруження називається концентраційним. У разі концентраційного перенапруги додаткові енергетичні витрати потрібні для того, щоб подолати наслідки дифузійного, міграційного і конвективного переносу потенциалопределяющих іонів.
Концентраційне перенапруження усувається перемішуванням і підвищенням електропровідності електроліту.
Друга складова перенапруги пов'язана з протіканням хімічної реакції. Це може бути як звичайна хімічна реакція, що йде в приелектродному шарі або на поверхні електрода, процеси адсорбції-десорбції, так і електрохімічна реакція, пов'язана безпосередньо з перенесенням електрона через кордон розділу фаз з електрода на молекулу або іон. Таке перенапруження іноді називають реакційним.
Якщо найбільш повільної стадією стає перенесення електрона, говорять про наявність перенапруженні електрохімічної стадії. В цьому випадку додаткові енергетичні витрати потрібні для підвищення енергії електронів матеріалу електрода. Потрібно підвищити їх потенційну енергію до енергії відповідних хімічних зв'язків реагенту і полегшити їх туннелирование до реагенту, що знаходиться в приелектродному шарі.
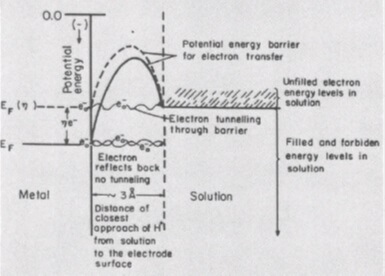
Третя складова перенапруги, фазова, з'являється в тому випадку, якщо електроліз пов'язаний з утворенням нової фази - бульбашок газу або плівки металу. Додаткові енергетичні витрати в даному випадку потрібні для подолання сили поверхневого натягу на стадії утворення зародків нової фази. Зняти фазовий перенапруження допомагають добавки до електроліту поверхнево-активних речовин.
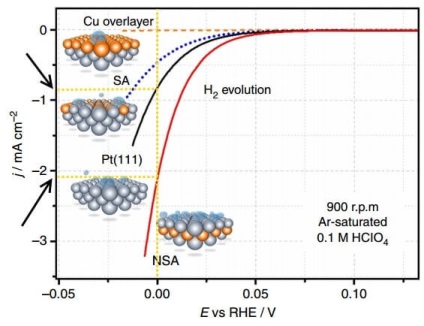
На малюнку представлені поляризаційні криві - залежно щільності струму (j) від потенціалу (E, щодо RHE, тобто оборотного водневого електрода) на різних електродах при виділенні водню (H2 evolution).
Поляризація - це різниця між рівноважним потенціалом електрода (тобто за відсутності струму) і його потенціалом під струмом, тобто грубо кажучи, перенапруження для окремого електрода. На графіку вище - це поляризація електрода, на якому відбувається виділення водню. Щільність струму в електрохімії - це спосіб вираження швидкості хімічної реакції. Таким чином, чим більше щільність струму при меншому перенапруженні (поляризації), тим краще, тобто тим швидше йде процес і тим менше енергетичних витрат на його здійснення.
Порівняємо щільність струму при E = 0 В для платинового немодифицированного електрода Pt (111) і модифікованого подслоем міді електрода NSA. На модифікованому електроді в одиницю часу виділяється приблизно в 2 рази більше водню.
З цієї точки зору зниження перенапруги, безумовно, підвищує ефективність електролізу. Інша справа, що для обчислення ККД електролізу в обговорюваному випадку потрібно, швидше за все, провести додаткові виміри і розрахунки, які покажуть, що модифікований подслоем міді електрод збільшити ККД в 2 рази не зміг.
Ну і трошки теорії на закінчення.
Якщо концентраційне перенапруження можна знизити перемішуванням і збільшенням електропровідності розчину, фазовий - добавками поверхнево-активних речовин, то реакційний перенапруження, пов'язане з протіканням хімічної реакції, усувається застосуванням каталізаторів. В даному випадку таким каталізатором став подслой міді на платиновому електроді.
Виділення водню при електролізі води пов'язане з обрзованеім проміжних частинок - атомів водню, адсорбованих на електроді, так званих адатомів. Для ефективного виділення водню зв'язок адатомів з поверхнею електрода не повинна бути ні занадто сильної, ні дуже слабкою. З усіх відомих чистих металів оптимальної енергією зв'язку з адатома водню володіють платиноїди, ось чому на платині перенапруження виділення водню - одне з найнижчих.