Під електролітами розуміють солі, кислоти, підстави, які у водному розчині в більшій чи меншій мірі розпадаються (дисоціюють) на вільні рухливі іони.
Натрій і хлор, наприклад, знаходяться в кристалі кухонної солі також у вигляді іонів, але пов'язаних іонної гратами. У процесі розчинення вона внаслідок дисоціації стає рухомий, і решітчаста структура розривається молекулами води.
Іони є електрично заряджені частинки, які при дисоціації електролітів стають рухливими в водному розчині, їх з'єднанню перешкоджають молекули води.
Додамо, наприклад, кухонну сіль в воду, - іони натрію і хлору стануть рухливими. В поле постійного струму (рис. 3) позитивно заряджені частинки рухаються катода (катіони), негативно заряджені - до анода (аніони).
Валентність відповідає значенню позитивного або негативного заряду.
Основні катіони, що знаходяться в організмі:
мекв / л = г / дл Х 1,04 (рН 5,08)
Після введення системи одиниць СІ концентрації катіонів та аніонів будуть позначатися в ммоль / л (1 ммоль = відносною атомною або молекулярної масі в мг). Для однозарядних іонів (наприклад, Na +, K +) значення не змінюються (1 ммоль = 1 мекв), для багатовалентних вони будуть іншими (Са2 +: 1 ммоль = 2 мекв).
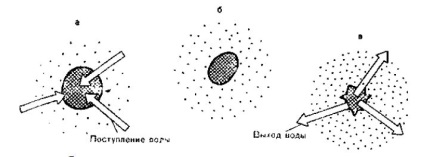
Мал. 5. Зміна обсягу еритроцитів в залежності від осмотичного давши-лення розчинів хлориду натрію різної концентрації.
а - гіпотонічний розчин хлориду натрію: набухання еритроцитів аж до розриву (гемоліз);
б - ізотонічний розчин хлориду натрію; в - гіпертонічний розчин хлориду натрію;
зморщування еритроцитів (форма зморщеного яблука).
Осмоляльність означає осмотичний число на 1 кг розчинника, осмолярність - на 1 л розчину.
Осмотичний тиск розчину залежить від числа осмотично активних частинок (іонів і недіссоціірованних молекул), які знаходяться в певному обсязі.
Одиниця осмотичного тиску - осмолу або мосммоль (мілліосммоль). Якщо 1 моль глюкози (відносна молекулярна маса 180,2; 1 моль = 180,2 г) знаходиться в 1 кг води, то цей розчин має «ідеальну» осмоляльность, рівну 1 осммоль. Якщо ж внести в 1 кг води 1 моль кухонної солі (відносна молекулярна маса = 58,4; 1 моль = 58,4 г), то утворюється «ідеальна» осмоляльность в 2 осммоль, так як кухонна сіль розпадається на іони натрію і хлору, внаслідок чого в розчині з'являється подвійну кількість частинок на відміну від глюкози. У розчинах, що містять повністю диссоциирующие солі, осмотичний тиск спрощено можна визначити за кількістю катіонів та аніонів (так звана ідеальна осмоляльность). При цьому, звичайно, нехтують межіонним взаємодією, яке впливає на осмоляльність і веде до «реальної» осмоляльности.
Осмотические співвідношення відповідальні за розподіл води, в різні рідинні простору в ортанізме (рис. 5, див. Також 1.4.3).
Осмотичний тиск визначають виміром зниження точки замерзання (осмометрі).
Осмоляльність плазми становить 290 мосммоль (кг води 38 ° С), (Geigy).
Плазма складається в основному з диссоциирующих електролітів, при цьому натрій по наближеному розрахунку визначає половину осмоляльности плазми. Вплив неелектролітів в нормальному стані незначно: Глюкоза: 100 мг / дл = 5,5 мосммоль / л плазми (Geigy) Сечовина: 100 мг / дл = 17,2 мосммоль / л плазми (Geigy) На основі цих уявлень можна розрахувати осмоляльность плазми, якщо відомо кількість натрію, сечовини і глюкози (Mansberger et al.):
Відмінності між розрахунковою і виміряної осмоляльностью доводять присутність невідомих розчинених речовин (токсини?) І служать показаннями для гемодіалізу (Mans-berger і співавт.).
Низька осмоляльность спостерігається тільки при гіпонатріємії; гіперосмоляльності стан, навпаки, багатозначно (Mansberger et al. гипернатриемия; гіперглюкоземія; уремія; невідомі речовини; комбінація багатьох факторів).
Для практичних цілей з наведених міркувань можна зробити висновок, що концентрація натрію в плазмі визначає її осмоляльність. Відхилення спостерігаються особливо часто при діабеті, уремії і в присутності невідомих розчинених речовин. У зв'язку з цим точне вимірювання осмоляльності необхідно в кожному окремому випадку.
Ефективне осмотичнийтиск
Для визначення відхилень в осмотичний тиск використовують напівпроникні мембрани. Речовини, частково проходять через клітинні мембрани, наприклад сечовина, викликають відхилення осмотичного тиску тільки в тих кількостях, які перешкоджають проникності клітинних мембран. Таким чином, ефективне осмотичнийтиск створюється тільки істинними іонами.
Нормальна осмоляльність плазми (290 мосммоль / кг води) є відправною точкою для тонічності.
Ізотонічними розчинами є (приблизно):
-1/6 молярні розчини солей, молекули яких повністю дисоціюють
на 2 іона, наприклад 1/6 молярний розчин кухонної солі;
- 1/3 молярні розчини, якщо розчиняється речовина не дисоціює, наприклад 1/3 молярний розчин глюкози.
Розчини, які виявляють меншу в порівнянні c плазмою осмоляльность, яляются гіпотонічними; розчини, що володіють більш високою осмоляльностью, є гіпертонічними.
Осмоляльність клітини відповідає такий плазми [Black, Moore, Burck, 1962]. При цьому потрібно враховувати, що частина електролітів в клітці залишається недиссоциированной. На осмотичний тиск у клітині постійно впливає обмін речовин: при розпаді великих молекулярних сполук на певну кількість дрібніших осмоляльность підвищується, при синтезі вона знижується.
Колоїдно-осмотичний тиск відповідає ступеню участі білків в осмоляльности.
Так як білкові молекули дуже великі, число частинок на одиницю маси значно менше, ніж в разі електролітів. Колоїдно-осмотичний тиск плазмових білків становить лише 1,6 мосммоль / кг води (25 мм рт. Ст.). Це становить 0,55% загальної осмоляльности плазми. Найбільший внесок вносить альбумін (85%, Geigy). Незважаючи на малу величину осмоляльности плазми, колоїдно-осмотичний тиск має велике значення, тому що білки можуть виходити з кров'яного русла тільки повільно. З цього стає зрозумілим вплив колоїдно-осмотичного тиску на розподіл води між плазмою і міжтканинної рідиною. Падіння концентрації альбуміну в плазмі, наприклад, знижує її здатність утримувати воду (гіпопротеінеміческіе набряк; відновлення об'єму циркулюючої крові).
Розподіл катіонів та аніонів в окремих рідинних просторах
Як можна бачити з рис. 6, концентрація електролітів в окремих рідинних просторах тіла неоднакова. Плазма і міжтканинна рідина істотно відрізняються тільки за змістом в них білків: міжтканинна рідина містить білка приблизно 0,4 г / дл (Geigy), лімфа - 3,9 г / дл (Groh і співавт.), Однак плазма - 6,6- 8,0 г / дл (Geigy). Невеликі відмінності в іонному складі плазми і міжтканинної рідини обумовлені Gibbs-Donnan-розділі-ням.
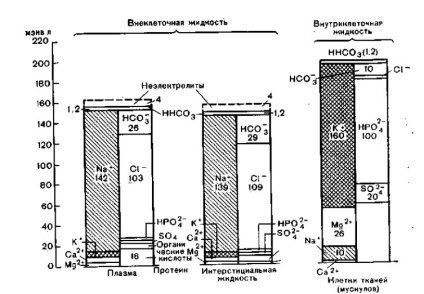
Мал. 6. Розподіл катіонів та аніонів на окремі компоненти в мекв / л плазми або інтерстиціальної рідини і в мекв / кг води для внутрішньоклітинної рідини.
Представлено в формі так званої монограми ліва половина кожного стовпчика - катіони, права-аніони (Geigy).
Вельмирізна концентрація електролітів у внутрішньо-і позаклітинному рідинних просторах: у позаклітинному містяться головним чином натрій, хлор і гідрокарбонат, у внутрішньоклітинному - калій, магній і фосфат, а також визначається висока концентрація сульфату і білків.
Відмінності в розподілі іонів між клітинами і позаклітинним простором існують не тільки у людини, на і у всіх тварин і рослин (Rapqport).
Ці відмінності в концентрації поддзржіваются всупереч тенденції до вирівнювання внаслідок дифузії через мембрану. Різниця концентрацій утворює біоелектричний потенціал, необхідний для збудливості нервів і м'язів. Збереження (відмінностей в концентраціях калію і натрію між клітинами і позаклітинним простором є активним запасом клітини, пов'язаним з енергією обміну речовин, Він, найімовірніше, витрачається на активні транспортні механізми, видалення натрію з клітини ( «натрієвий насос»), а також накопичення калію ( «калієвий насос»).