ЕЛЕКТРИЧНА ПРОВІДНІСТЬ РОЗЧИНІВ
Електрична провідність c - скалярна фізична величина, введена для кількісного оцінювання здатності провідника пропускати струм і дорівнює відношенню величини струму I в провіднику до напруги U на кінцях цього провідника
c - величина, зворотна електричному опору c = 1 / R. її розмірність [Ом - 1] = [См - сименс].
Провідність - величина екстенсивна, тобто залежить від розмірів провідника. Для того, щоб виключити розміри провідника і кількісно оцінити здатність провідника пропускати струм, введена скалярна фізична величина - питома провідність k. рівна відношенню твори провідності c провідника і його довжини l до поперечного перерізу S провідника:
З формули (1.2) випливає, що розмірність питомої провідності [Див × м - 1 або Ом - 1 × см - 1].
Залежності питомої провідності водних розчинів деяких електролітів від концентрації наведені на рис. 1.1. Як видно з рис. 1.1, при з ® 0 величина питомої провідності електролітів наближається до значення провідності чистої води, яка становить приблизно 10 - 5 Див × м - 1 і обумовлена присутністю іонів H3 O + і OH -. що виникають в результаті дисоціації води: 2H2 O = H3 O + + OH -. Зі збільшенням концентрації електроліту питома провідність спочатку зростає, що пов'язано зі збільшенням числа іонів в розчині, а потім зменшується. Чим більше іонів в розчині, тим сильніше виявляється іон-іонну взаємодія, що приводить до зміни структури розчину, до уповільнення руху іонів. Тому залежності питомої провідності водних розчинів електролітів від концентрації можуть характеризуватися максимумом. Іноді, внаслідок обмеженої розчинності, фіксують лише висхідну гілку кривої (рис. 1.1).
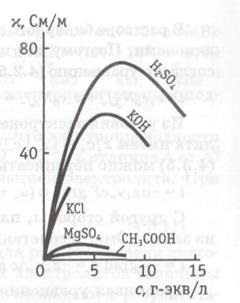
Мал. 1.1. Залежність питомої електропровідності
водних розчинів сильних електролітів від концентрації
Еквівалентна електрична провідність електроліту l дорівнює відношенню питомої провідності розчину до концентрації розчину, вираженої в кілограм-еквівалентах розчиненої речовини на м 3:
де l - еквівалентна електрична провідність розчину [Cм × м 2 × кг-екв - 1]; до - питома електрична провідність розчину; с - концентрація (кг-екв × м - 3); Vo = с - 1 - розведення.
Якщо використовувати розмірність питомої електричної провідності [к] - [Див × см - 1], концентрації [з] - [г-екв × л - 1], то
Нескінченно розбавлений розчин характеризується граничним значенням еквівалентної електричної провідності lо при a = 1, яка дорівнює сумі еквівалентних електропровідностей окремих іонів: катіонів - і аніонів -:
Властивість адитивності граничної електричної провідності, яке виражається рівнянням (1.5), відоме під назвою закону незалежного переміщення іонів Кольрауша.
Іони різної хімічної природи володіють різними значеннями еквівалентної електричної провідності (табл. 1). Як видно з табл. 1, максимальним значенням еквівалентної електричної провідності характеризуються іон водню, дещо меншим - гідроксид іон, еквівалентні електричні провідності інших іонів у водному розчині мало відрізняються між собою і знаходяться в інтервалі значень 40-80 Див × см 2 × г-екв - 1.
Відповідно до теорії електролітичноїдисоціації Аррениуса для розчинів слабких електролітів:
де a - ступінь дисоціації слабкого електроліту; l - еквівалентна електрична провідність розчину електроліту, для якого визначається a; lо - еквівалентна електрична провідність нескінченно розведеного розчину.
Для розбавлених розчинів сильних електролітів залежність l від концентрації досить точно апроксимується емпіричним рівнянням Кольрауша:
де l - еквівалентна електрична провідність розчину електроліту, lо - еквівалентна електрична провідність нескінченно розведеного розчину, b - емпіричний коефіцієнт, с - концентрація, г-екв × л - 1.
За невеликим винятком, питома провідність водних розчинів електролітів збільшується з підвищенням температури і задовільно описується рівнянням:
де k25 - провідність при 25 о С; t - температура, при якій розраховують питому провідність kt; k - температурний коефіцієнт провідності.
Граничні значення еквівалентної електричної провідності різних іонів у воді при температурі 25 о С
. Див × см 2 × г-екв - 1
Величина температурного коефіцієнта може бути розрахована на підставі вимірювання провідності розчину електроліту при двох температурах, наприклад, при 25 і 75 о С.
Вимірювання електричного опору розчину електроліту в лабораторному практикумі проводять за допомогою моста змінного струму на частоті 50 Гц, принципова схема якого наведена на рис. 1.2. У найпростішому вигляді міст містить чотири опору: Rх - опір судини з досліджуваним електролітом, Rм - опір магазину опорів, і опору R1 і R2. В одну діагональ мостової схеми включений осцилографічний індикатор нуля 0 типу ІНО-3М, а в іншу - джерело змінного струму.
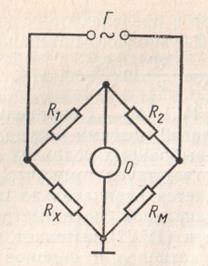
Мал. 1.2. Схема моста змінного струму для вимірювання
електричного опору розчинів
Балансування моста проводять за допомогою осциллографической трубки індикатора нуля ІНО-3М, на вертикально відхиляють, якій подається напруга з діагоналі, а на горизонтально відхиляють - напруга, що живить міст. На екрані електронно-променевої трубки викреслюється світиться еліпс. При балансі моста ток в діагоналі мінімальний, еліпс стягується в лінію, і виконується наступне співвідношення:
Якби кондуктометрична осередок для вимірювання опору розчинів електролітів мала перетин рівне 1 см 2. а електроди займали б все перетин судини і розташовувалися на відстані 1 см один від одного, то опір електроліту Rx. виміряний в такому посудині, було б чисельно дорівнює його питомому опору r. Тим самим ми могли б відразу розрахувати значення питомої електропровідності розчину електроліту як величину, зворотну питомому опору:. Виготовити осередок точних розмірів технічно важко, тому на практиці користуються для вимірювання опору розчинів електролітів осередками довільної форми і розмірів в залежності від провідності розчинів електролітів і їх концентрації (рис. 1.3). При цьому питому електропровідність розраховують за формулою:
де К - коефіцієнт пропорційності, званий постійної судини.
З (1.10) випливає, що
Величина До залежить від відстані між електродами, від їх площі та розташування відносно стінок посудини, а також від взятого об'єму розчину. В окремому випадку, коли електроди займають все перетин судини, постійна До дорівнює відношенню відстані між електродами до їх площі:
В цьому випадку постійну судини можна визначити безпосереднім виміром l і S. Саме цим методом користувався Кольрауш, який з великою точністю визначив електропровідність ряду електролітів (KCl, NaCl, KNO3 і ін.).
У лабораторній практиці постійну осередку визначають, вимірюючи опір певного обсягу електроліту з відомою питомою електропровідністю. Значення К розраховують за рівнянням (1.11).
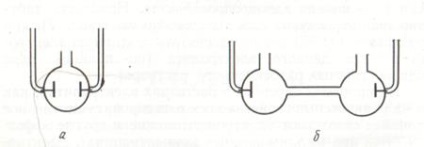
Мал. 1.3. Кондуктометрические осередки для вимірювання
опору розчинів електролітів, що мають
низьку (а) і високу (б) електропровідність