У наш час фізика стала дуже поширеною наукою. У буквальному сенсі вона присутня скрізь. Самий елементарний приклад: в вашому дворі росте яблуня, а на ній достигають фрукти, приходить час і яблука починає опадати, але в якому напрямку вони падають? Завдяки закону всесвітнього тяжіння наш плід падає на землю, тобто прямує вниз, але не вгору. Це був один з найвідоміших прикладів фізики, але давайте звернемо увагу на термодинаміку, а якщо точніше, то на фазові рівноваги, які не менш важливі в нашому житті.
термодинаміка

Для початку, давайте розглянемо цей термін. θερμοδυναμική- так виглядає слово на грецькій мові. Перша частина θερμо позначає «тепло», а друга δυναμική- «сила». Термодинаміка - це розділ фізики, який вивчає властивості макроскопічної системи, а також різні способи перетворення і передачі енергії. В цьому розділі спеціально вивчаються різні стани і процеси для того, щоб в опис можна було ввести поняття температура (це фізична величина, яка характеризує термодинамічну систему і вимірюється за допомогою певних приладів). Всі процеси, що відбуваються в термодинамічних системах описуються тільки мікроскопічними величинами (тиск і температура, а також концентрація компонентів).
Рівняння Клапейрона-Клаузіуса
Кожен фізик знає це рівняння, але давайте ми його розберемо по частинах. Воно відноситься до рівноважним процесам переходу певної матерії з однієї фази в іншу. Це прекрасно видно на таких прикладах: плавлення, випаровування, сублімація (один із способів консервації продуктів, який проходить шляхом повного видалення вологи). За формулою добре видно перебіг передвиборних процесів:
- n = PV / RT;
- де Т-температура речовини;
- Р-тиск;
- R-питома теплота фазового переходу;
- V-зміна питомої обсягу.
Історія створення рівняння

Рівняння Клапейрона-Клаузіуса є прекрасним математичним поясненням другого закону термодинаміки. Також згадується як «нерівність Клаузіуса». Природно, теорема була розроблена самим ученим, який хотів пояснити взаємозв'язок між тепловим потоком в системі і ентропією, а також її оточення. Це рівняння Клаузиус розробив в своїх спробах пояснити ентропію і визначити її в кількостях. У прямому сенсі теорема дає нам можливість визначити, чи є циклічний процес оборотним або він незворотній. Ця нерівність пропонує нам кількісну формулу для розуміння другого закону.
Замкнута ізольована система
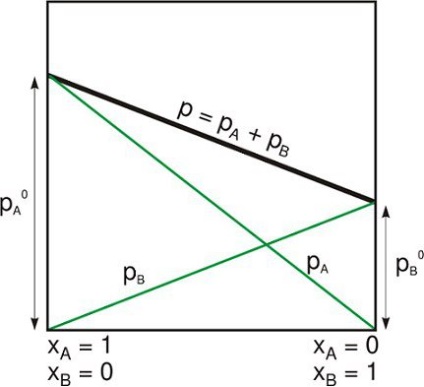
Ізольована система є одним із таких способів:
- Фізична система далека від інших, які не взаємодіють з ними.
- Термодинамічна система закрита жорсткими нерухомими стінками, через які ні матерія, ні енергія не може пройти.
Незважаючи на те що суб'єкт внутрішньо ставиться до своєї власної гравітації, ізольовану систему зазвичай приймають за межі зовнішніх гравітаційних та інших далеких сил.
Це може бути протиставлено того, що (в більш загальній термінології, використовуваної в термодинаміки) називається замкнутою системою, яка охоплюється вибірковими стінками, через які можна передавати енергію у вигляді тепла або роботи, але не матерії. І з відкритою системою, в яку матерія і енергія входять або виходять, хоча у неї можуть бути різні непроникні стіни в частинах її кордонів.
Ізольована система підпорядковується закону збереження. Найчастіше в термодинаміки речовина і енергія розглядаються як окремі поняття.
термодинамічні переходи
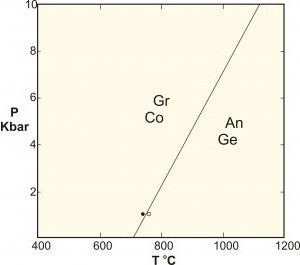
Щоб зрозуміти квантові фазові переходи, корисно зіставити їх з класичними трансформаціями (також званими тепловими зверненнями). CPT описує точку повернення в термодинамічних властивостях системи. Він сигналізує про реорганізацію частинок. Типовим прикладом є замерзає перехід води, який описує плавне перетворення між рідиною і твердим тілом. Класичні фазові переростання обумовлені конкуренцією між енергією системи і ентропією її теплових флуктуацій.
Класична система не має ентропії при нульовій температурі і, отже, не може відбутися фазове перетворення. Їх порядок визначається першим розривних похідним термодинамічних потенціалом. І, звичайно ж, має перший порядок. Фазові перетворення від феромагнетика до парамагнетиків є безперервним і має другий порядок. Ці постійні зміни від впорядкованої до невпорядкованою фазі описуються параметром порядку, які дорівнюють нулю. Для вищезгаданого феромагнітного перетворення параметр порядку буде являти собою повну намагніченість системи.
потенціал Гіббса
Вільна енергія Гіббса - це максимальна кількість робіт без розширення, які можуть бути прибрані з термодинамічної закритої системи (яка може обмінювати тепло і працювати з навколишнім середовищем). Такий максимальний результат може бути отриманий тільки в повністю оборотному процесі. Коли система трансформується зворотним чином з першого стану в друге, зменшення вільної енергії Гіббса одно виконуваної системою в її оточенні, за вирахуванням роботи сил тиску.
стану рівноваги

Термодинамічне і механічне рівновагу є аксіоматичної концепцією термодинаміки. Це внутрішній стан однієї або декількох систем, які з'єднані більш-менш проникними або непроникними стінками. В даному стані немає чистих макроскопічних потоків з матерії або енергії, або в рамках системи або між системами.
У своїй власній концепції стану внутрішніх рівноваг макроскопическое зміна не відбувається. Системи одночасно перебувають у взаємних теплових, механічних, хімічних (константи), радіаційних равновесиях. Вони можуть бути в одному виді. У цьому процесі всі види зберігаються відразу і нескінченну кількість часу до тих пір, поки не буде порушена фізична операція. У макроскопічному рівновазі відбуваються абсолютно точні збалансовані обміни. Вище наведені доказ - це фізичне пояснення даного поняття.
Кожні закони, теореми, формули мають свої основи. Давайте розберемо 3 основи закону фазового рівноваги.
- Фаза являє собою форму матерії, однорідну за хімічним складом, фізичним станом і механічному рівноваги. Типові фази - тверді, рідкі та газоподібні. Дві незмішувані рідини (або рідкі суміші з різними складами), розділені окремої кордоном, вважаються двома різними фазами і не змішуються твердими частинками.
- Кількість компонентів (С) - це число хімічно незалежних складових системи. Мінімальна кількість незалежних видів, необхідних для визначення складу всіх фаз системи.
- Число ступенів свободи (F) в цьому контексті - це число інтенсивних змінних, які не залежать одне від одного.
Класифікація за фазовим равновесиям
- Реакції суцільного чистого перенесення (часто звані твердофазна реакціями) відбуваються між твердими матеріями різного складу. Вони можуть включати елементи, виявлені в рідинах (H, C), але ці елементи зберігаються в твердих фазах, так що в якості реагентів або продуктів не задіяні рідкі фази (H2 O, CO2). Тверді реакції чистого перенесення можуть бути безперервними або переривчастими, а також термінальними.
- Поліморфні представляють собою особливий тип твердофазной реакції, яка включає фази ідентичного складу. Класичними прикладами є реакції між силікатами алюмінію кианит-силіманіт-андалузит, конверсія графіту в алмаз при високому тиску і рівновагу карбонату кальцію.
закони рівноваги

Фабричне правило Гіббса було запропоновано Іосіей Уіллардом Гиббсом в його знаменитій статті під назвою «Рівновага гетерогенних речовин», яка виходила у світ з 1875 по 1878 роки. Воно застосовується до нереакционноспособниє багатокомпонентним гетерогенним системам в термодинамічній рівновазі і є заданим рівністю:
- F = C-P + 2;
- де F - число ступенів свободи;
- C - число компонент;
- P - число фаз в термодинамічній рівновазі один з одним.
Число ступенів свободи - це кількість незайнятих інтенсивних змінних. Найбільша кількість термодинамічних параметрів, таких як температура або тиск, які можуть варіюватися одночасно і довільно, не зачіпаючи один одного. Прикладом однокомпонентной системи є система з одним чистим хімічною речовиною, а двокомпонентні, такі як суміші води і етанолу, мають два незалежні компоненти. Типовими фазовими переходами (рівновага фаз) є тверді речовини, рідини, гази.
Фазовий правило при постійному тиску
Для додатків в галузі матеріалознавства, що стосуються фазових змін між різними твердими структурами, часто виникає постійний тиск (наприклад, в одній атмосфері) і ігнорується як ступінь свободи, тому правило стає таким: F = C - P + 1.
Іноді вводять цю формулу під назвою «правило з конденсованої фазою», але, як ми знаємо, воно не застосовується до даних систем, які схильні до високих тисків (наприклад, в геології), оскільки наслідки цих тисків можуть заподіяти катастрофічні наслідки.
Може здатися, що фазовий рівновагу - просто порожній звук, і мало в яких фізичні процеси цей момент задіяний, але, як ми побачили, без нього багато знайомих нам закони не працюють, тому потрібно трішечки ознайомитися з цими унікальними, барвистими, хоч і трохи- трохи нудним правилами. Ці знання допомогли багатьом людям. Вони навчилися застосовувати їх до себе, наприклад, електрики, знаючи правила роботи з фазами, можуть захистити себе від непотрібної небезпеки.
