Класифікація двокомпонентних сумішей. Якщо, внаслідок тепло-вого руху молекул, з рідини в паровий простір в одиницю часу переходить стільки ж молекул, скільки переміщається назад з пари в рідину, то між рідкою сумішшю, укладеної в замкнутому посудині, і паром над нею встановлюється рухлива фазовий ". рівновагу.
Тепловий рух молекул є причиною розширення газу, яке виявляється як «термічне тиск». Воно тим більше, чим вище температура і чим більше молекул в одиниці об'єму. Для ідеальних газів термічне тиск прямо пропорційно. абсолютної температурі і обернено пропорційно питомій обсягом. Термічне тиск рідини, що володіє, як відомо, значно меншим питомим об'ємом, ніж газ, при певній температурі досягає декількох тисяч атмосфер, т. Е. Значно більше, ніж газу. В ідеальних газах, і ^ практичні та в парах, термічне тиск зрівняні-вешівается зовнішнім тиском; в рідинах воно в значній мірі компенсується спрямованим в протилежну сторону до о г е з и - онним тиском, яке обумовлюється внутрішніми сі-лами тяжіння молекул. Надлишок термічного тиску над когезійний - и ним - це тиск пара.
Парціальні тиску газоподібним чи рідким суміші слід також розглядати як термічне тиск окремих компонентів, зменшене на величину когезионних сил. У сумішах ідеальних газів і парів, в яких когезійні сили мізерно малі, парціальний давши-ня кожного компонента одно термічному тиску і, слідчий-но, при даній температурі пропорційно числу молекул відпо-ного компонента в одиниці об'єму.
Так як парціальні тиску компонентів в суміші рідин визначаються в основному когезійний силами, то необхідно перш - за все розглянути взаємодію окремих молекул.
Нехай сила, з якою притягуються в рідини дві сусідні мо-лекул одного компонента, буде ап, сила взаємного тяжіння двох молекул другого компонента а22 і, нарешті, а12-сила тяжіння молекул двох неоднакових компонентів.
Якщо сили АІ, а22 і а12 рівні між собою, то рідини взаємно розчинні один в одному в будь-яких відносинах і їх суміші називаються і д е а л ь. н и. м і. р а з т в о р а м і.
Загальна сила, з якою будь-яка молекула утримується в суміші, не залежить у цьому випадку від складу суміші, так як байдуже, окру-дружина чи молекула великою кількістю молекул першого або другого компонента. Парціальний тиск компонента залежить лише від числа його молекул, що досягають в одиницю часу поверхні рідини з мінімальною швидкістю, необхідної для подолання когезионних сил. При даній температурі тиск відповідного компонента віз-розтане пропорційно його вмісту в рідині.
В ідеальних розчинах рівновагу між рідиною і парою уста-новлюється за законом Рауля.
Якщо сила тяжіння молекул двох неоднакових компонентів ап буде менше сил а1х і а22, то молекули утримуються в розчині слабкіше, ніж в тому випадку, коли їх оточують молекули тільки одного компонента. Тому молекули легше переходять в паровий простір, і парціальний тиск в такому розчині вище, ніж в ідеальному розчині (суміші з позитивним відхиленням від закону Рауля).
Є також суміші, в яких сила А12 значно більше сил ап і а22. Тоді молекули сильніше утримуються в чистих компонен-тах, і тому парціальні тиску менше, ніж в ідеальних розчинів-рах (суміші з негативним відхиленням від закону Рауля).
Якщо сила А12 дуже мала в порівнянні з а1Х і а22, то однакові молекули прагнуть з'єднатися, а різні молекули відокремлюються одна від одної. В цьому випадку суміші розшаровуються і, отже, складаються з взаємно нерозчинних рідин.
Крім ідеальних розчинів і сумішей взаємно нерозчинних рідин, є суміші рідин, що володіють частковою розчинністю один в одному.
Таким чином, всі рідкі двокомпонентні суміші, в залежно-сті від ступеня взаємної розчинності їх компонентів, можна розділити на три групи:
рідини, взаємно розчинні в будь-яких відносинах;
рідини, частково розчинні один в одному;
рідини, взаємно нерозчинні.
Рідини, взаємно розчинні в будь-яких відносинах. Коли рідка суміш складається з двох компонентів, повністю розчинних один в одному, то пружність парів кожного компонента знижується і загальний тиск парів суміші, температура кипіння і концентрація пари не є постійними, змінюючись залежно від зміни со-става рідкої суміші.
Рідини, взаємно розчинні в будь-яких відносинах, діляться на три групи:
1. Суміші рідин, розчинних в будь-яких відносинах, що не володіють постійною темпе-ратура кипіння. Виділяється при випаровуванні таких рідко-стей пар за своїм складом відрізняється від складу рідкої суміші, причому легко-летючого компоненту в парах над рідиною завжди більше, ніж в рідко-сти. Температура кипіння цих сумішей в залежності від їх складу змінюється в межах від температури кипіння одного чистого компонента до температури кипіння іншого компонента.
Суміш двох рідин, взаємно розчинних в будь-яких відносинах, являє собою систему, що складається з двох фаз і двох компонентів, і, отже, за правилом фаз є системою, що має дві сте-пені свободи.
Однак для практичних цілей одну змінну вважають постійного-ної і будують діаграму фаз в плоскій системі координат. При цьому можна отримати наступні фазові діаграми: тиск-температура (склад постійний), тиск-склад (температура постійна), температура-склад (тиск постійне).
Як приклад розглянемо фазові діаграми для двох - компонентної суміші бензол-толуол.
Ця суміш є ідеальною, і тому парціальні тиску компонентів за законом Рауля (при постійній температурі) рівні: легколетучего компонента А (бензолу)
Труднолетучем компонента В (толуолу)
Де Р д-пружність пара чистого компонента А; Рм-пружність пара чистого компонента В; Ха -молекулярная частка компонента А в рідини; 1 - ха -молекулярная частка компонента В в рідині.
Знаючи величини РА і pBj знаходимо обшее тиск Р парів суміші як суму парціальних тисків компонентів
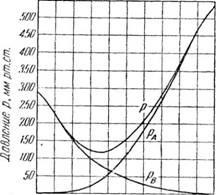
З наведених трьох рівнянь видно, що при постійній темпера-турі парціальні тиску компонентів, а також загальний тиск парів суміші знаходяться в лінійній залежності від молекулярної частки хА легко-летючого компонента в рідині. На рис. 376, / ці залежності пред-ставлені графічно, причому прямі ОВ і DA зображують зміна парціальних тисків компонентів, а пряма АВ-зміна обшего тиску.
Щоб визначити температуру кипіння суміші заданого складу, будують зазначеним вище способом ряд ізотерм АВ, А'В ', А "В", висловлюю щих загальний тиск парів при різних температурах (/, Ґ, і "). Лінії парціальних тисків РА і рв отримують з'єднанням точок А, А ', А "з точкою D і точок В, В', В" з точкою О.
Далі проводять горизонтальну пряму MN відповідно зовн-нього тиску. Відновивши з точки, яка відповідає цьому со-ставухА * вертикальну лінію до перетину з лінією MN, знаходять точку R на изотерме T. При цій температурі T загальний тиск пара суміші дорівнює зовнішньому тиску, і температура T буде температурою кипіння суміші составахА-
Якщо визначити таким чином температуру кипіння сумішей раз-ного складу (при одному і тому ж тиску), то, відклавши по осі абсцис склади, а по осі ординат відповідні температури кипіння, по-лучают криву кипіння, наведену на рис. 376, II, для суміші бен-зол-толуол. Верхня крива на малюнку показує рівноважний со-ставши пара при температурі кипіння суміші.
При складі суміші хх часткою благаючи легколетучего (бензолу) і тим-пературі tx практично є тільки одна рідка фаза-суміш бензолу і толуолу. З підвищенням температури суміші до t2 з'явиться парова фаза складу х2. Так як тиск постійно, то при наявності двох фаз буде тільки одна ступінь свободи і, отже, зі зміною тим-ператури зміниться і склад фаз.
При подальшому підвищенні температури кількість рідкої фази стане зменшуватися, а паровий збільшуватися, і при температурі коли склад пара виявиться рівним складу первісної суміші,
На цій же діаграмі можна зобразити процес послідовної конденсації, виходячи з парової фази составах2, і шляхом ряду послідовно-вательного процесів конденсації і випаровування отримати рідина, со-стоїть з одного чистого труднолетучем компонента.
Взаємне положення кривих в фазових діаграмах визначається першим законом Д. П. Коновалова: пар збагачується тим компонентом, додавання якого до рідини підвищує тиск пари над нею або знижує її температуру кипіння. Цей закон можна застосувати до будь жид-ким сумішей. Додаток бензолу до суміші бензол-толуол знижує температуру її кипіння, і тому концентрація бензолу в парі буде вище, ніж в рідині. З рис. 376 видно, що це відповідає такому располо-жению кривих, при якому крива складу пара завжди вище кривої складу рідини.
Діагональ відповідає рівному змістом легколетучего компо-нента в парі і рідини = у.
Крива рівноваги для розчинів, що підкоряються закону Рауля, може бути побудована (див. Стор. 457) за рівнянням
УА = _____________ (3-165)
Де а- відносна летючість. По мірі збільшення числа а,
Тим сильніше відхиляється крива від діагоналі, тим більше розходження в со-ставі пара і рідини і тим легше розділити суміш на компоненти. На діа-грамі у-х фазові точки пара і рідини зливаються в одну точку, завжди лежить на кривій рівноваги.
Крива рівноваги і діагональ обмежують область взаємного існування двох фаз. Вище кривої рівноваги розташована область пара, а нижче-область рідини.
Типовими прикладами таких сумішей є водні розчини мінеральних кислот, наприклад водні розчини азотної і соляної кислот.
Фазові діаграми для суміші азотна кислота-вода представлені на рис. 377.
Чиста вода кипить при 100 °, чиста азотна кислота-прі 86 °, рас-твор ж HN03 в воді при вмісті HN03 68,5% вагу. кипить при по-постійної температурі 121,9 °.
На t-х-діаграмі (рис. 377, II) крива залежності температури кипіння такої суміші від її складу має максимум температури кипіння (точка М). У згоді з законом Коновалова верхня крива від-віча складу пара, нижня-складу рідини при різних темпера-турах кипіння і постійному тиску.
На рис. 377, III зображена у -х-діаграма для суміші азотна киць-лоти-вода. Точка М, в якій крива перетинає діагональ, соответ-
0 10 20 30 40 50 60 70 80 00 100
/ Про 20 30 40 50 60 70 80SO77777Содержал / іє леллол / е / пу / його / азотної і і їло П7ь /),% тлII
Мал. 377. Діаграми р-х (1), І-х (11) иу-Х (111) для суміші з максі-бітної температурою кипіння (азот-ва кислота-вода).
Ствует однаковому складу рідини і пара; її називають характеристичної точкою. Наявність такої точ-ки вказує на те, що суміш неможливо розділити на со-ставлять її чисті когось компонентами.
3. Суміші рідко-стей, взаємно рас - ЮО творяться в будь-яких від-носіння, що володіють при деякому певному складі постійною температурою кипіння, меншою температури кипіння чистих компонентів, що складають суміш (сме-сі, що володіють мінімальною температурою кипіння). При перегонці таких рідин з деякою постійною температурою кипіння склад пара буде однаковий зі складом рідини і: отже, їх також неможливо розділити на чисті компоненти.
Типовими прикладами таких сумішей є суміші етилового спирту з водою і етилового спирту з бензолом.
З однаковим складом рідини і пара.
Суміші, що володіють максимумом або мінімумом температури ки-співу, при перегонці можна розділити на нераздельнокіпящую суміш складу х0 в відгоні і надлишковий (порівняно зі складом нероздільно - киплячій суміші) компонент в залишку; отримати обидва компонента в чистому вигляді шляхом перегонки таких сумішей неможливо.
Як приклад розглянемо фазову діаграму на рис. 377, II. Рідина початкового складу х> х0 кипить при температурі tx і дає пар складу у, збагачений більш летючим компонентом. В процесі пе-регонкі рідина буде збагачуватися менш летючим компонентом і точка х переміщається вліво. В результаті можна отримати чистий більш ле-тучій компонент в дистилляте і нераздельнокіпящую суміш складу х0 в залишку, але подальше розділення суміші неможливо, так як вона кипить без зміни складу
Якщо початкова суміш має склад х '<Сх0, то она закипает при температуре tx и дает пар состава у', обогащенный менее летучим компо-нентом. В процессе перегонки точка х' перемещается вправо, и перегонка приводит к разделению смеси на менее летучий компонент в дистилляте и нераздельнокипящую смесь в остатке.
Рідини, частково розчинні один в одному. Дослідження сме-сей частково розчинних один в одному рідин були вперше прове-ку Абашево і Алексєєвим [4]. Алексєєв показав можливість построе-ня характерних параболічних кривих розчинності. Кожна з кривих складається з двох гілок, що сходяться разом в температурної точці "найбільшою розчинності. До цієї точки обидві рідини при змішень дають в певних межах концентрацій два шари, представ-ляющие собою два розчину різного складу (розчин рідини А в) рідини В і розчин рідини в в рідині А). у загальній точці обидва розчини володіють однаковим складом.
Температура, що відповідає цій максимальній точці, називається критичною температурою розчинення. При більш високій температурі обидві рідини змішуються, т. Е. Взаємно розчиняються в будь-яких відносинах.
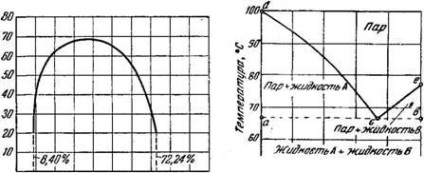
Класичним прикладом частково розчинних рідин є фенол і вода. При 20 ° вода розчиняє 8,4% фенолу, а при 50 ° раство-рімость фенолу у воді збільшується до 12,08%. Фенол в свою чергу розчиняє воду при 20 ° в кількості 27,76% і при 50 ° -37,17%.
Якщо взаємну розчинність фенолу і води зобразити на діа-грамі (рис. 379), то виявляється, що криві розчинності представ-ляють одну криву, що проходить через максимум в точці, відповідаю-щей складу 35,99% фенолу при £ = 68,8 °.
Коли в системі є тільки одна рідка і одна парова фази, то ^ до неї застосовні всі, що було сказано про рідинах, повністю рас
творяться одна в іншій. При двох рідких фазах і однієї парової давши-ня парів суміші залишається постійним до тих пір, поки зберігаються обидва шару, т. Е. Така система є різновидом суміші взаємно нерозчинних рідин.
Спостерігаються і такі випадки обмеженої розчинності двох рідин, коли повна взаємна розчинність настає не при підвищенні, а при зниженні температури. Прикладом може служити суміш води і триетиламіну, для якої існує мінімальна критична температура розчинення, рівна 20 °.
Мал. 380. ДіаграммаT-х для Несміт - Шива рідин.
Деякі суміші двох рідин (наприклад, нікотину і води) мають максимальну і мінімальну критичні температури розчинів-ренію і, отже, крива їх взаємної розчинності представляє замкнуту лінію.
Рідини, взаємно нерозчинні. Коли змішані дві взаємо-нерозчинні рідини, то кожна з них повністю зберігає свої властивості. Така суміш легко може бути розділена на складові частини механічним шляхом, за допомогою відстоювання. Система складається з двох компонентів і трьох фаз і, отже, має одну ступенем сво-боди. Це - вказує на те, що кожній конкретній температурі суміші буде відповідати цілком певний тиск і кожен з компонентів буде вести себе так як ніби він знаходиться один в чистому вигляді.
Іншими словами, в суміші, що складається з взаємно нерозчинних рідин, парціальний тиск кожного компонента не залежить від його змісту в суміші і дорівнює тиску пари чистого компонента при тій же температурі.
Горизонталь ab на діаграмі обмежує область існування суміші рідин А і В, а точка з відповідає стану кипіння суміші, причому температура кипіння суміші лежить нижче температури кипіння окремих компонентів. Ця властивість використовується в техніці для
перегонки висококиплячих рідин з парою. Співвідношення між ваго-вимі кількостями компонентів в парах знаходять за формулою
Абсолютно нерозчинних рідин в природі не існує; ступінь їх розчинності в великій мірі залежить від температури. В не-яких випадках незначної розчинність нехтують, вважаючи рідини практично взаємно нерозчинними, що дає можливість користуватися наведеною формулою (3-166).
Найпростіша схема екстракційної установки періодичного дей-наслідком для екстрагування твердих тіл показана на рис. 401. Суміш, біля-жащая екстрагуванню, завантажується в екстрактор 1, куди одночасно заливається і певну кількість чистого розчинника. Через '...
Молекулярна дифузія. При рівновазі фаз їх склад залишається незмінним. Дифузійні процеси протікають лише при порушенні фазового рівноваги, при цьому розподіляється між фазами компо-нент переходить з однієї фази в іншу. В ...