БУДОВА АТОМА ФОСФОРУ
Фосфор розташований в III періоді, в 5 групі головній підгрупі «А», під порядковим номером №15. Відносна атомна маса Ar (P) = 31.
1 S 2 + 2 S 2 + 2 P 6 3 S 2. 3 P 3. фосфор: p - елемент, неметалл
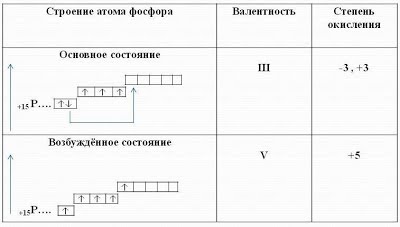
Валентні можливості фосфору ширше, ніж у атома азоту, так як в атомі фосфору є вільні d орбіталі. Тому може статися розпарювання 3 S 2 - електронів і один з них може перейти на 3 d - орбіталь. У цьому випадку на третьому енергетичному рівні фосфору виявиться п'ять неспарених електронів і фосфор зможе виявляти валентність V.
У вільному стані фосфор утворює кілька аллотропних видозмін: білий, червоний і чорний фосфор
Знаходження в природі
БІОЛОГІЧНА РОЛЬ СОЕДИНЕНИЙ ФОСФОРУ
Фосфор присутній в живих клітинах у вигляді орто- і пірофосфорної кислот, входить до складу нуклеотидів, нуклеїнових кислот, фосфопротеидов, фосфоліпідів, коферментів, ферментів. Кістки людини складаються з гідроксилапатиту 3Са3 (РО4) 3 · CaF2. До складу зубної емалі входить фторапатит. Основну роль в перетвореннях сполук фосфору в організмі людини і тварин грає печінку. Обмін фосфорних сполук регулюється гормонами і вітаміном D. Добова потреба людини у фосфорі 800-1500 мг. При нестачі фосфору в організмі розвиваються різні захворювання кісток.
· Червоний фосфор практично нетоксичний. Пил червоного фосфору, потрапляючи в легені, викликає пневмонію при хронічній дії.
· Білий фосфор дуже отруйний, розчинний в ліпідах. Смертельна доза білого фосфору - 50-150 мг. Потрапляючи на шкіру, білий фосфор дає важкі опіки.
Гострі отруєння фосфором проявляються печіння в роті і шлунку, головним болем, слабкістю, блювотою. Через 2-3 діб розвивається жовтяниця. Для хронічних форм характерні порушення кальцієвого обміну, ураження серцево-судинної і нервової систем. Перша допомога при гострому отруєнні - промивання шлунка, проносне, очисні клізми, внутрішньовенно розчини глюкози. При опіках шкіри обробити уражені ділянки розчинами мідного купоросу або соди. ГДК парів фосфору в повітрі 0,03 мг / м³.
Фосфор отримують з апатитів або фосфоритів в результаті взаємодії з коксом і кремнеземом при температурі 1600 ° С:
Пари, що утворюються білого фосфору конденсуються в приймачі під водою. Замість фосфоритів відновленню можна піддати і інші сполуки, наприклад, метафосфорную кислоту:
Хімічні властивості ФОСФОРУ
Фосфор є найважливішим біогенним елементом і в той же час знаходить дуже широке застосування в промисловості.
Мабуть, перша властивість фосфору, яке людина поставила собі на службу, - це горючість. Горючість фосфору дуже велика і залежить від аллотропическими модифікації.
Найбільша активність хімічно, токсичний і горючий білий ( «жовтий») фосфор. тому він дуже часто застосовується (в запалювальних бомбах та ін.).
Червоний фосфор - основна модифікація, вироблена і споживана промисловістю. Він застосовується у виробництві сірників, його разом з тонко подрібненим склом і клеєм наносять на бічну поверхню коробка, при терті сірникової головки до складу якого входять хлорат калію і сірка, відбувається займання. Так само червоний фосфор використовується при виробництві вибухових речовин, запальних складів, палив.
Фосфор (у вигляді фосфатів) - один з трьох найважливіших біогенних елементів, бере участь в синтезі АТФ. Велика частина виробленої фосфорної кислоти йде на отримання фосфорних добрив - суперфосфату, преципітату, і ін.
Оксид фосфору (V) - фосфорний ангідрид
Фізичні властивості: Оксид фосфору (V) Р2 ПРО5 - білий гігроскопічний порошок (поглинає воду), слід зберігати в щільно закритому посуді.
Отримання: Виходить при горінні фосфору в надлишку повітря або кисню
Застосування: Оксид фосфору (V) дуже енергійно сполучається з водою, а також забирає воду від інших з'єднань. Застосовується як осушувач газів і рідин.
Хімічні властивості: Оксид фосфору (V) - це кислотний оксид. взаємодіє, подібно іншим кислотних оксидів з водою, основними оксидами і підставами.
Фосфорний ангідрид особливим чином взаємодіє з водою, взаємодіючи з водою при звичайних умовах (без нагрівання). утворює в першу чергу метафосфорную кислоту НРО3:
при нагріванні утворюється ортофосфорна кислота H3 PO4:
Найбільше практичне значення має ортофосфорна кислота Н3 РO4.
Будова молекули: У молекулі фосфорної кислоти атоми водню з'єднані з атомами кисню:
Фізичні властивості: Фосфорна кислота являє собою безбарвне, гігроскопічна тверда речовина, добре розчинна у воді.
1) Взаємодія оксиду фосфору (V) з водою при нагріванні:
2) Взаємодія природного солі - ортофосфата кальцію з сірчаною кислотою при нагріванні:
3) При взаємодії фосфору з концентрованою азотною кислотою