Мал. 29. Електрична схема установки для вимірювання е. д. з. гальванічних елементів
Стандартні потенціали дають уявлення про можливе направлення окислювально-відновних хімічних реакцій. проте в реальних умовах цей напрямок може бути іншим з наступних причин. Окислювально-відновні системи. в залежності від швидкості реакцій. протікають на електродах, підрозділяються на оборотні та необоротні. Стандартні потенціали оборотних систем виміряні безпосередньо описаним вище способом, тоді як стандартні потенціали необоротних систем в більшості випадків знаходять шляхом термодинамічних розрахунків. Внаслідок цього на практиці їх величини виявляються іншими, так як на них впливають багато факторів. Наприклад, для необоротних систем не спостерігається закономірного зміни потенціалу відповідно до зміни концентрації компонентів системи. і розрахунки, проведені з використанням стандартних окислювальних потенціалів і концентрацій компонентів. носять скоріше ілюстративний характер, ніж відповідають дійсним даним. Тому набагато більшого практичного значення мають формальні (реальні) потенціали окисно-відновних систем. Формальні потенціали (ф) знаходять, виміром е. д. з. гальванічного елемента. в якому початкові концентрації компонентів окіслі- [c.350]
Вираз (У.5) дозволяє використовувати е. д. з. гальванічного елемента для термодинамічних досліджень процесів. протікають на електродах. Складність цих досліджень полягає в тому, що при прямому підключенні до гальванічного елемента звичайного вимірювального приладу (вольтметра) термодинамічна рівновага в системі порушується. Це, як було показано раніше, призводить до спотворення результатів, оскільки вимірюється не е. д. з. елемента Е, а різниця електростатичних потенціалів його електродів і иям. Під час вимірювань дотримуються всі правила роботи з використовуваним вимірювальним приладом. Вимірюють температуру розчинів. [C.165]
Джерело постійного струму (див. Рис. 28) слід включати рубильником Р, а потім ключем До включати нормальний елемент або гальванічний елемент. е. д. з. якого вимірюється. Вимикати в зворотному порядку. Якщо при вимірюванні е. д. з. будь-яким потенціометром відсутня компенсація, потрібно перевірити правильність складання вимірювальної установки за схемою (див. рис. 28) включення полюсів випробуваного елемента і джерела струму. а також контакти. Коливання в паралельних вимірах вказують на поганий контакт в головній ланцюга (кола джерела струму). При відсутності струму в бічному ланцюзі перевірити всі контакти і стан провідників. Не можна, щоб в скляних шлифах для контакту і в електролітичному мосту були повітряні бульбашки. Клеми на металевих пластинках електродів не повинні стосуватися розчинів. Необхідно систематично перевіряти напругу джерела струму і проводити калібрування потенціометра. Підключати досліджуваний гальванічний елемент і нормальний елемент ключем до потенціометра слід тільки на час вимірювання е. д. з. і на дуже малі проміжки часу, щоб виключити поляризаційні явища і зміна концентрації іонів в розчинах за рахунок роботи елемента. Для уменьшеція дифузії іонів з одного напівелементу в інший їх з'єднують електролітичним мостом, тільки перед виміром е. д. з. Зберігають мости в насиченому розчині солі. Електроди і гальванічні елементи збирають в скляних судинах. форми яких описані в роботах. [C.142]
Гальванічні елементи такого роду називаються кон-центраціоннимі елементами. Практично ці елементи не застосовуються для одержання струму. але з точки зору теорії і методики вимірювання вони представляють певний інтерес. Наприклад, на підставі е. д. з, такого елемента можна визначити невідому нам концентрацію іонів. [C.165]
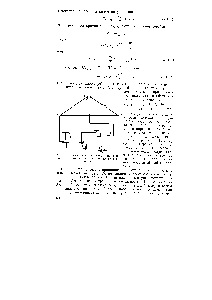
На рис. 129 приведена ірінціпіальная схема вимірювання е. д. з. гальванічного елемента. Компенсаційна схема складається нз джерела струму - акумулятор 1, напруга якого подається на реохорд АВ, гальванометра 2 чутливістю 10 а елемента Вестона досліджуваного елемента 4 нерек ночателя 5 переривника 6 і рухомого контакту С. Метод заснований па тому, що вимірювана е. д. з. уравновещівается (компенсується) е. д. з. акумулятора. [C.298]
Дивитися сторінки де згадується термін Гальванічнийелемент для вимірювання pH елемент. [C.268] [c.424] [c.195] [c.126] [c.138] [c.309] [c.304] Визначення рН теорія і практика (1968) - [c.0]