Хімія і хімічна технологія
Будова електронних рівнів атомів цих елементів характеризується майже повною добудовою -подуровня передостаннього рівня шість -у заліза, сім - у кобальту і вісім - у нікелю. Заповнення -подуровня у атомів цих елементів позначається на зменшенні окисного числа. оскільки на / -подуровне міститься менша кількість непарних електронів (див. Курс хімії. ч. 1. Загальнотеоретична, гл. 11, стр. 86). Тому якщо марганцю властиво ще окислительное число +7. то атом заліза може віддавати не більше 6 електронів і, отже, його окисне число не може бути більше +6. Окислювальне число кобальту НЕ можег бути більше +5, а нікелю -1-4. Таким чином. у атомів цих елементів вже не можна вважати всі електрони незаповнених рівнів валентними. Одночасно з підвищенням стійкості майже зг (виконаного / -подуровня знижується схильність цих елементів до металлообразним з'єднанням з електронною провідністю. [C.126]

Мал. 20-23. Цитохром с, який представляє собою глобулярні білок з 104 амінокислотами, пов'язаними в один ланцюг, і групою гема. містить атом заліза. На цьому схематичному малюнку кожна амінокислота умовно представлена пронумерован-
Будова електронних рівнів атомів заліза, кобальту та нікелю характеризується майже повною добудовою -подуровня передостаннього електронного рівня шість електронів - у заліза, сім-у кобальту і вісім - у нікелю. Заповнення -подуровня у атомів цих елементів позначається на зменшенні окисного числа. оскільки на -подуровне міститься менша кількість непарних електронів. Тому якщо марганцю властива ще ступінь окислення 4-7, то атом заліза може віддавати не більше шести електронів і, отже, його ступінь окислення не може бути більше 4-6. Окислювальне число кобальту не може бути більше 4-5, а нікелю 4-4, Таким чином. у атомів цих елементів не можна вважати всі електрони незаповнених рівнів валентними. Одночасно з підвищенням стійкості майже заповненого -подуровня знижується схильність цих елементів до утворення металлоподобних з'єднань з електронною провідністю. Електричну провідність такого типу мають тільки сіліди цих металів. [C.297]
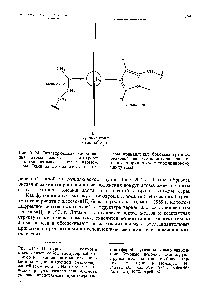
Аналогічна гібридизація має місце і у перехідних елементів. При цьому комбінуються 3d-, 4s- і 4 / -орбіти. Особливий інтерес представляє s / j d-гібридизація. Полінг показав, що при цьому виникають шість еквівалентних електронних тяжів, спрямованих, наприклад, уздовж позитивних і негативних напрямків осей х, у, г (октаедричні гібридизація). Ці гібридизації залучалися для пояснення будови комплексних сполук типу іонів Fe (N) s або Со (ИНз) б. Атом заліза має зовнішні електрони (3df (4s). Іон Ре + має будову (3d) "(4s) Видається енергетично вигідним порушити три електрона з З-стану в 4р-стан. Тоді у виниклому йоні здійснюється стан (МУ (4s) ( 4р). Два / -Електронна, один 4s і три 4р дають октаедричні гібридизацію. приводить до шести сильним зв'язків. компенсуючим енергію, витрачену иа збудження. [c.480]
Іноді невеликі зміни навколишнього середовища можуть викликати серйозні зміни в формі білка. що позначиться на його функціях. Наприклад, легке зростання pH крові змінює молекулу гемоглобіну так, що вона стає здатною проходити до внутрішньої поверхні легенів і в молекулі відкривається атом заліза. в результаті легко зв'язується кисень. При зниженні pH ланцюг знову згортається, допомагаючи виділити кисень після перенесення його до клітки, де він необхідний. [C.455]
Стикаючись з електролітом, атоми металу, розташовані на поверхні споруди (трубопроводу), піддаються впливу силового поля молекул води. які можуть впроваджуватися в кристалічну решітку металу споруди. Силовий вплив може бути настільки сильним, що порушується зв'язок атомів металу з кристалічною решіткою. Відірвані таким чином атоми металу споруди переходять в електроліт, утворюючи іон-атом, несучий заряд. Навколо іон-атома орієнтуються молекули води, що представляють собою диполі. Атом заліза переходить в електроліт, маючи позитивний заряд. а спорудження виявляється негативно зарядженим. Так виникає подвійне електричний шар. при якому гідратованих іони заліза під дією електричних сил взаємодії з негативними зарядами споруди утримуються у поверхні конструк ції. Може наступити такий момент, коли під впливом електричних сил в подвійному електричному шарі настає рівновага і подальший перехід атомів стали в електроліт припиняється. [C.6]
Скільки грамів алюмінію відновлюють з окису заліза а) 5,6 г заліза б) 4 г-атом заліза [c.102]
Передбачення валентності. Якщо виходити з положення, що валентність атома дорівнює числу неспарених електронів його зовнішньої оболонки. то атоми інертних газів не повинні давати ніяких з'єднань з іншими атомами, оскільки в основному стані спини всіх електронів спарені. Тим часом відкриті і досліджені сполуки благородних газів з галогенами і киснем, як Хер. ХеО 4, Хе 2 і ін. Ще складніше пояснити існування так званих сендвічевим з'єднань. наприклад ферроцена, де атом заліза пов'язаний з двома циклічними молекулами СДН. (Рис. 17). Він мав би утворити зв'язку з десятьма атомами вуглецю, не володіючи десятьма електронами у зовнішній електронній оболонці. [C.57]
Яке співвідношення (у відсотках) хрому і заліза в ферохрому, в якому на кожні три атома хрому доводиться один атом заліза [c.162]
Згідно рівнянням (1) і (2) 1 г-атом заліза реагує з 1,5 Моля хлору і 1 г-атом міді - з 1 молем хлору. У цьому випадку кількість хлору. що вступив у реакцію з Fe і Сі, може бути виражено наступним рівнянням [c.450]
Обчислення маси атома заліза в грамах. 1 г-атом заліза округлено важить 55,85 з число атомів в цій кількості одно 6-10. Маса 1 атома заліза = 55,85 г 6-10 = 9,3-г. Подібні завдання можна вирішувати і наступним шляхом, [c.7]
Гідрування окису вуглецю з утворенням спиртів і вуглеводнів вище Gj являє собою відносно повільну каталітичну реакцію. Андерсон [27с] розрахував, що молекула окису вуглецю живе на поверхні кобальтового каталізатора близько 5 хв. перш ніж вона прореагує. Всі активні каталізатори синтезу содерн ат залізо, іікель, кобальт або рутеній в якості основного гидрируются компонента. Ці чотири металу в умовах синтезу повільно, але з вимірної швидкістю утворюють карбоніли металів, що, мабуть, має певне значення. Оптимальна температура синтезу для нікелю і кобальту знаходиться в межах 170-205 °, для заліза 200-325 ° і для рутенію 160-225 °. Допустиме максимальне тиск для синтезу на нікелевих каталізаторах становить приблизно 1 ат, на кобальтових - близько 20 ат. При більш високому тиску активність цих каталізаторів різко падає (з підвищенням тиску). Залізні каталізатори. що готуються плавленням магнетиту, проявляють активність під тиском 20-100 ат i, в той час як обложені залізні каталізатори вище 20 ат слабшають I27d]. Рутенієвого каталізатори щодо неактивні при тиску нижче 100 ат, але їх активність швидко зростає в міру його підвищення до 300 ат [27е]. При оптимальних тисках (О-1 ат для Ni 1-20 ат для Go, 1-20 ат для обложених Fe-каталізаторів, 20-100 ат для плавлених Fe-каталізаторів і 100-300 ат для ЬІ) коефіцієнт тиску (показник п в рівнянні швидкість = коістат та х тиск ") становить близько 0-0,5 для Ni і Go і близький до одиниці для Fe і Ru. [c.521]
Оксиди і гіороксіди. Залізо утворює з киснем дотримуюся -ище прості окснди Рео, РеоОо і РеОз, Оксид Рео має основний характер. РегОз-амфотерний, РеОз - кислотний. Перші два окснда здатні з'єднуватися, утворюючи сметанний окснд Рсз04, в якому один атом заліза знаходиться в етенені окислення + 2, а два інших - певною мірою окислення -ЬЗ. [C.302]
Замість цього було виділено помаранчевий продукт реакції. в молекулу якого виявився включеним і атом заліза Паралельно в США група хіміків отримала точно таке ж з'єднання. Вони вирішили, що ця речовина - біс-ціклопентадіенілжелезо. [C.218]

Велике значення має комплексообразование заліза з біолігандами [2, с. 165-184]. Особливо важливий гемоглобін - залізовмісних білкова молекула. виконує в крові тварин і людини функції переносника кисню. Гемоглобін містить білок Глобино і чотири гема. що представляють собою порфіриновий комплекс заліза (II), де атом заліза утворює зв'язок з чотирма атомами азоту порфіринового кільця і одну зв'язок з атомом азоту гістідіна- амінокислоти, що входить до складу б1елка глобина. Шосте місце в координаційній сфері заліза (II) може бути зайнято молекулярним киснем О2, а також лигандами типу СО, си і ін. Якщо гемоглобін вступив у взаємодію, наприклад, з СО, він втрачає здатність оборотно приєднувати О2. В такому випадку організм гине від гіпоксії. Цим пояснюється висока токсичність СО, СК - і подібних до них лігандів. [C.134]
Скільки закису-окису заліза Ре Р4 утворюють 6 г-атом заліза прн їх повному сгораніп в повітрі Відповідь виразити в молях і грамах. [C.107]
VII.4, де точкам 2 і 3, наприклад, відповідають ступеню окислення Fe (II) і Fe (III). У комплексі Na2 [Fe (N) 5NO], представленому на малюнку точкою 4, в залежності від того, який заряд приписати нітрозогрупи N0 позитивний, нульовий (група нейтральна) або негативний, атом заліза міг би мати ступінь окислення (II), (III ) або (IV). Судячи за хімічним зрушення е2рз / 2 (711,0 еВ на відміну від 710,0 еВ для Кз [Ре (си) б] і 708,7 для К4 [Ре (си) б]), ступінь окислення заліза в комплексі дорівнює ( IV). Це вказує і на те, що заряд нітрозогрупи негативний. [C.159]
Зверніть увагу на множник 2, який з'явився в другій сходинці. Відповідно до формули FeSj на один атом заліза доводиться 2 атома сірки, тому наша система перепишеться у вигляді Fe 2-le- = Fe 1 [c.97]
Обширний клас комплексних сполук представляють Санд-Вічева комплекси, родоначальником яких є ферроцен, Ферроцен є жовто-помаранчеві кристали металоорганічного з'єднання в якому атом заліза розташовується між двома високосімметрічнимі п'ятичленних кільцями. освіченими атомами вуглецю (див, схему 13.7). [C.369]
Зв'язок в ферроценов можна розглянути з позицій спрощеної теорії молекулярних орбіталей [80]. Кожне циклопентил-діенільное кільце має п'ять молекулярних орбіталей три заповнені зв'язують орбіталі і дві вакантні розпушують орбіталі (розд. 2.9). Зовнішня електронна оболонка атома заліза складається з дев'яти атомних орбіталей однієї 45-, трьох 4р- і п'яти Зс (-орбіталей. Шість заселених орбіталей двох ціклопентадіенільних кілець перекриваються з одного з-, трьома р- і двома -орбіталей атома заліза, даючи дванадцять нових орбіталей , з яких шість є зв'язують і утворюють дві потрійні зв'язку кільце-метал. Додаткове зв'язування виникає в результаті перекривання вакантних розпушуючих орбіталей кілець з іншими населеними -орбіталей заліза. Таким чином. на дев'яти Орбітал ях розташовано 18 електронів (можна вважати. що 10 електронів дають два кільця, а 8 - атом заліза в нульовому окислювальному стані) шість орбіталей - сильно зв'язують, а три - слабо зв'язують або несвязивающіе. [c.72]
A. Отримайте сіль Мора (ИН4) 2504-Ре304-6Н20. Обчисліть кількість 25% -й сірчаної кислоти. необхідне для розчинення 0,5 г заліза, і візьміть 1,5-кратний надлишок. Залізний порошок насипте в пробірку, долийте сірчану кислоту і обережно нагрійте. Коли метал розчиниться. розчин профільтруйте і упарьте в порцеляновій чашці до початку освіти кристалічної кірки на поверхні. Приготуйте гарячий насичений розчин сульфату амонію з розрахунку, щоб на 1 атом заліза припадала молекула сульфату ам.мо-ня. Отримані розчини змішайте гарячими і залиште кристалізуватися при 0 ° С. Виділилися кристали відокремте від рідини і висушіть фільтрувальної папером. Зважте сіль і розрахуйте вихід у відсотках від взятого заліза. [C.398]
Випав осад фільтрують, промивають холодною водою і висушують при 40-50 С. Гексабеізо-ат заліза (III) -речовини кремінного кольору, на повітрі стійкий, у воді не розчиняється, добре розчинний в ацетоні, з якого його можна перекрісталлнзовать, [c.264 ]
Ферроцен, перший з металлоценов, синтезований в 1951 р (Кім і Посон), має сандвічеобразное будова - між двома паралельними ціклопентадіенільнимі кільцями розташований атом заліза, причому молекула володіє центром симетрії (XVI). Згодом були отримані інші металлоцени типу XVI, в яких атом заліза був замінений на атоми Ti, V, Сг, Мп, Со, N1, Рі, Оз, Mg. [C.307]
При числі атомів заліза, більшому одиниці. утворюється кластер (рій), в якому, як припускають, існує одноелектронні зв'язок між атомами заліза. Кластер містить крім ци-стеіна також лабільну сірку і може приймати нли віддавати один електрон. Білок типу 1РЕ-5, тобто що містить один атом заліза, саме рубредоксін, був ретельно вивчений різноманітними методами. В результаті було доведено, що єдиний атом заліза в молекулі білка оточений чотирма залишками цистеїну, розташованими в вершинах тетраедра. Обидва (окислене і відновлене) стану комплексу - високоспіновие. Ці білки мають молекулярну масу близько 6000 і можуть Рис 1У5 Будова передавати (на молекулу) один електрон. [C.366]
Дивитися сторінки де згадується термін Атом заліза. [C.219] [c.121] [c.192] [c.367] [c.219] [c.16] [c.15] [c.150] Твори Науково-популярні, історичні, критико-бібліографічні і інші роботи по хімії Том 3 (1958) - [c.229]