хрому оксид
Хрому оксидів. В системі СrО (рис.) Існують оксиди СrО, СrО2. Сr2 О3 і ін. Властивості хрому оксид о. зіставлені в табл. Нижчий оксид СrО метастабілен, його точка складу в системі Сr-Сr2 О3 потрапляє в область розшаровування розплаву, яка простягається від 2 до 48 ат.% О. В цій системі можна знайти й інконгруентно плавиться оксид Сr3 О4. існуючий при температурах вище
1550 ° С. Він має перекручену структуру шпінелі.
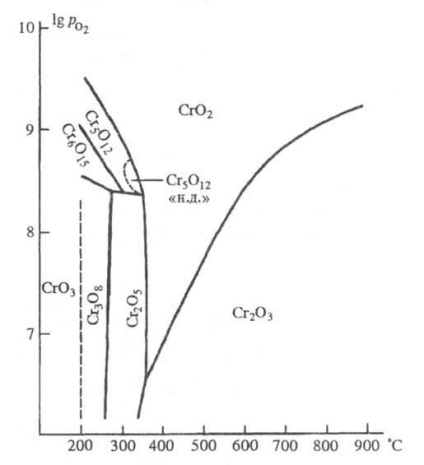
Області стійкості оксидів хрому: - тиск кисню (Па); "Н.д." - низького тиску.
СrО - червоні кристали або чорний пірофорний порошок; кристаллич. СrО стійкий на повітрі, не розчинний у воді, але інтенсивно окислюється вище
100 ° С. Реагує з НCl з виділенням водню, з розведеним HNO3 і H2 SO4 не взаємодіє. Отримують СrО термодинамічно розкладанням карбонила Сr (СО) 6. Використовують як адсорбент для очищення вуглеводнів від О2.
Гідроксид Сr (ОН) 2 коричневого або жовтого кольору осідає з розчинів солей Сr (II) лугами під час відсутності кисню; твір розчинності 2,0 x 10 -20; не розчинний в розчинах лугів і розбавлених кислотах, повільно розчинний у конц. кислотах; на повітрі швидко окислюється.
Оксид Сr (III) (сесквіоксід) Сr2 О3 (мінерал есколаіт) має структуру типу корунду (форма). Його колір змінюється від світло-зеленого у тонкодисперсного матеріалу до майже чорного у великих кристалів. При нагріванні зелений колір можна зупинити переходить в коричневий. Існують аморфний Сr2 О3. а також метастабільна кубіч.форма зі структурою типу шпінелі (а = 0,836 нм) коричневого кольору. Описана також тетрагон. модифікація (а = 0,9480 нм, с = 0,5160 нм), по-видимому, стійка вище 1000 ° С. Сr2 О3 помітно летуч вище
1200 ° С; випаровується конгруентно, з дисоціацією в парах; уравенную температурної залежності тиску пари lgp (мм рт. ст.) = 10,62 - 25300 / Т (1504 - 1821 К); парамагнетик, при 32 К (точка Нееля) переходить в антіферромагн. стан, переходу 0,80 кДж / моль; напівпровідник, ширина забороненої зони
3,4 еВ; твердість за шкалою Мооса 9.
Властивості ОКСИДІВ хрому
* Інконгруентно. ** температура кипіння 3000 o С.
Сr2 О3 хімічно малоактивний. Не розчинний у воді і органічних розчинниках, не взаємодія з розчинами лугів, розчин. в сильних кислотах лише при тривалому нагріванні, окислюється і переходить в розчин при дії гарячих розчинів персульфат або хлоратов, а також 70% -ний НClО4. Окислюється расплавами KNO3 і КClО3. взаємодія з розплавами лугів на повітрі. При спіканні з оксидами або карбонатами металів утворює хроміти (див. Кульгавість). Взаимод. з хлором в присутності вуглецю при 650-850 ° С. вище
1500 ° С відновлюється до металу дією Н2. С, СО, Si, Al, Ca, Mg і т. П.
Отримують Сr2 О3 термодинамічно розкладанням гідроксиду або гідратованого хроміхромата (див. Нижче), СrО3. (NH4) 2 Cr2 O7. прокаливанием дихроматів Na або К з вугіллям з наступною вилуговуванням, спалюванням Сr в О2. Оксид високої частоти рекомендовано отримувати окисленням хроморганіческое з'єднання, наприклад етілбензолхрома. Використовують Сr2 О3 для отримання металеві. хрому та його карбідів, як пігмент, каталізатор органічне синтезу (окислення, крекінг, гідрування і дегідрування), як полірувальний матеріал, компонент вогнетривів, феритів.
Відомий ряд гідроксидів Сr (III). При дії на водні розчини солей Сr (III) лугу або аміаку утворюється гелеобразний осад Cr (OH) 3 x nH2 O. Розчинність гідроксиду у воді 1-10 -7% по масі при 25 ° С. Забарвлення його (блакитна, зелена, зеленувато-чорна або фіолетова), а також хімічний активність залежать від умов осадження. Гідроксид легко розчинний в мінеральних кислотах і розчинах лугів. У міру старіння опадів їх реакційна здатність падає. При висушуванні опадів утворюється гідрат Сr (ОН) 3 x ЗН2 О, який може бути отриманий в кристалічних. вигляді; структура гексагoн. (А = 1,230 нм, с = 0,970 нм, z = 8; по ін. Даним, а = 0,531 нм, с = 0,487 нм); щільність 1,64 г / см 3. малоустойчів, при зберіганні, а також при нагріванні до
70 ° С переходить в аморфний гідрат Сr2 О3 x 5Н2 О, стійкий до
85 ° С. При подальшому зневодненні отримують аморфний гідроксид Сr (ОН) 3. Кристалізується він в структурі типу байеріта Al (ОН) 3. решітка гексагoн. (А = 0,5288 нм, с = 0,4871 нм, z = 2); щільність 2,90 г / см 3; зневоднюється близько 150 ° С. Застосовують гідроксид для отримання солей Сr (III), каталізаторів, феритів.
Відомий також гідрат - смарагдова зелень, або зелень Гійє, складу Сr2 О3 x ПН2 О, де п змінюється від 1,5 до 2; не розчинний в мінеральних кислотах, розчинах лугів, легко розчинний в розчинах СrО3. Стійкий на повітрі. При нагріванні до
200 ° С втрачає велику частину води (залишається 0,5 Н2 О), але при витримці на повітрі знову її поглинає. Повністю зневоднюється близько 600 ° С. Отримують прожарювання суміші К2 Сr2 О7 з Н3 ВО3 при 500-600 ° С з подальшою вилуговуванням, нагріванням гідроксиду Сг в автоклаві з добавкою борної або кремнієвої кислоти або відновленням Na2 Cr2 O7 органічне в-вами (наприклад, меласою) в автоклаві. Застосовують як пігмент.
Оксогідроксід СrOОН (або Сr2 О3 x Н2 О) відомий у вигляді кілька модіфікацій.Модіфікація (мінерал Грімальді) утворює кристали блакитно-сірого, голубувато-зеленого або коричнево-червоного кольору; має ромбоедріч. структуру (а = 0,2960 нм, с = 1,329 нм, z = 3, просторів. група; щільність 4,12 г / см.Модіфікація зеленого кольору (мінерал гвіанаіт) має ромбіч. решітку (а = 0,4861 нм, b = 0,4292 нм, с = 0,2960 нм, z = 2, просторів, група Рптп); щільність 4,57 г / см 3. Третя модифікація (мінерал бресуелліт) червоно-коричневого кольору має ромбіч. структуру типу діаспора (а = 0,449 нм, b = 0,986 нм, с = 0,297 нм, z = 4, просторів, група Рbпт). Описана смарагдово-зелена-модифікація, теж ромбическая, зі структурою типу беміт (просторів. група стст). Є свідчення про існування ще однієї, кубічної, м одіфікаціі сіро-фіолетового кольору.
Оксогідроксід стійкий на повітрі, практично не реагує з мінеральними кислотами і розчинами лугів. Поведінка при нагріванні різниться у різних модифікацій. Обезвожіваніеформи відбувається при 370-440 ° С, -Модифікація - при 480-550 ° С, модифікації - при 520-570 ° С. Утворюється СЮОН при неповному зневодненні гідроксиду Сr (III). Проміжний час. продукт при отриманні Сr2 О3.
Діоксид СrО2 кристалізується в структурі типу рутилу; по нек-рим даними, має область однорідності (відношення Про: Сr від 1,901 до 2,013); ферромагнетик, володіє металеві. провідність; при 110 ° С переходить в парамагн. стан (без зміни структури). при
510 ° С розкладається до Сr2 О3. На повітрі стійкий, при тривалому кип'ятінні у воді диспропорционирует на СrOОН і Н2 СrО4. При дії соляної кислоти окисляє її з виділенням Cl2. Отримують СrО2 розкладанням СrО3 або Сr5 О12 або Сr3 О8 в гідротермальних умовах; робоча речовина носіїв магн. записи.
Відома аморфна парамагн. форма СrO2 коричневого або чорного кольору. Вона містить сліди води і зазвичай трохи менше кисню; її формулу іноді пишуть Cr5 O9 x aq. При повному зневодненні розкладається. Як гідрат діоксиду можна розглядати гідроксохромат [Сr (ОН) 2] 2 СrO4. який випадає з розчинів, що містять Сr (III) і Cr (VI) при рН 3-4; коричневе рентгеноаморфное речовина, що містить додатково 5-5,5 молекул води; напівпродукт при отриманні деяких з'єднань Сr.
Описано гідроксохромати Сr (III) - це Сr (ОН) 2 (НСrO4) x 4Н2 О (при стоянні з маточним розчином він перетворюється в СrО2 x 2Н2 О) і Сr5 (ОН) 9 (СrO4) 3 x ПН2 О. Всі вони аморфні , легко розчинний у розведених мінеральних кислотах і розчинах лугів, при нагріванні обезвоживаются і при
250 ° С розкладаються. Гідроксохромати хрому (III) загальної формули xСr2 О3 x yСrО3 x NН2 Про часто називають хроміхроматамі.
Вказувалося на існування оксидів Сr4 О7 і Сr6 О11.
Оксид Сr5 О12 - хромат (VI) хрому (III). Мабуть, це фаза змінного складу, чия область однорідності лежить в інтервалі складів СrO2,4 - СrО2,48 (по ін. Даним, від СrO2,385 до CrO2,430). Дрібні чорні голки. Не розчинний у воді, розчинний у розведених мінеральних кислотах; оксид, отриманий при високому тиску, розкладається конц. H2 SO4 при кип'ятінні. Наведені в табл. структурні параметри відносяться до неферромагн. модифікації високого тиску. Структура ферромагн. (Щільність 3,29 г / см 3) модифікації низького тиску не вивчена.
Оксид Сr2 ПРО5 також містить хром в двох ступенях окислення, його структурна формула Сr2 (СrО4) 2 (Сr2 О7). Описано дві його модифікації - моноклінна антиферомагнітна з температурою Нееля нижче 80 К і існуюча при високому тиску ромбическая, для якої запропонована формула Сr6 О15. Це чорні пластинчасті кристали. Не реагує з водою і розведеними кислотами, розчинний в конц. H2 SO4 при кімнатній температурі. Виходить при термодинамічно розкладанні СrО3 або Cr3 O8 в атмосфері О2 (270-300 o С).
Як гідрат Сr2 ПРО5 можна розглядати гідроксоді-хромат Сr (ОН) Сr2 О7 x2Н2 О, осаждающийся з водних розчинів. Це коричневе аморфне речовина, розчинний у розведених кислотах і лугах; при 100-160 ° С зневоднюється, при 250-350 ° С розкладається.
Оксид Сr3 О8 [або Сr2 (Сr2 О7) 2 (Сr3 О10) - дуже дрібні темно-коричневі кристали; антиферромагнетик, температура Нееля
Хімічна енциклопедія. Том 5 >> До списку статей