Гроссе Е. Вайсмантель X.
Хімія для допитливих. Основи хімії і цікаві досліди.
ЗАЗИРНЕМО У МИНУЛЕ
І зараз в болотах гниють рослини. Гниючий мул можна знайти в стоячій воді ставка або поблизу від берега повільно поточного струмка. Відбуваються при цьому хімічні перетворення подібні до тих процесів, з яких починалося освіту вугілля і нафти. Перевіримо це за допомогою досвіду.
Отримаємо болотний газ
Принесемо зі ставка трохи мулу. Можна взяти замість нього і землю з дна болота. Разом з мулом або землею там же наберемо води. Цим мулом заповнимо на одну третину велику скляну банку з-під консервів. Після цього доверху наллємо в банку болотної води. Зверху зміцнимо скляну воронку, а до неї шматком гумового шланга приєднаємо коротку скляну трубку з витягнутим кінцем. Вихід з воронки закриємо за допомогою затиску на гумовому шлангу.
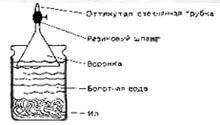
Поступово утворюються бульбашки газу, що заповнюють лійку. Після цього можна з обережністю відкрити затискач і негайно підпалити виділяється газ. Горіння обумовлено, в основному, тим, що до складу болотного газу входить метан.
Метан - перше в ряду з'єднання вуглецю. Він містить тільки вуглець і водень. Формула метану СН4. В його молекулі чотири атома водню пов'язані з одним атомом вуглецю. Однак зображена тут формула не дає повного уявлення про просторове будову молекули метану. Дослідження показали, що всі чотири атома водню знаходяться в вершинах правильного тетраедра, тобто розташовані однаково щодо атома вуглецю, який знаходиться в центрі.
Метан виходить не тільки при гнитті. Багато метану міститься в суміші газів, яка утворюється при сухій перегонці вугілля. Крім того, він є головною складовою частиною багатьох природних газів, а також побічним продуктом переробки нафти. В даний час метан служить найважливішим сировиною для отримання водню, оксиду вуглецю СО та інших речовин. При неповному згорянні метану виходить сажа (вуглець в тонкоподрібненому стані), яка використовується, зокрема, як наповнювач у виробництві гуми.
Вуглець звичайно, не можна віднести до числа найбільш поширених хімічних елементів. У земній корі його всього лише 0,12%. Але від всіх інших елементів він відрізняється винятковою різноманітністю хімічних сполук. Число відомих в даний час сполук вуглецю більш ніж удвічі перевищує кількість з'єднань всіх інших елементів, разом узятих.
Таке своєрідність вуглецю пояснюється особливими здібностями його атомів до утворення хімічних зв'язків.
Як правило, вуглець чотиривалентний. Його атоми можуть приєднуватися один до одного з утворенням більш-менш довгих ланцюгів а також кілець. Залишаються при цьому вільні одиниці валентності легко насичуються воднем. В результаті виходять вуглеводні.
З найпростішим з них - метаном - ми вже познайомилися. Наступний, більш складний вуглеводень називається етаном. Його молекула містить два атоми вуглецю і шість атомів водню.
Приєднання третього атома вуглецю і насичення вільних валентностей воднем приводить до утворення пропану з формулою C3 H8.
Наступний вуглеводень з чотирма атомами вуглецю називається бутаном і має склад С4 Н10.
Так само можна скласти все довші вуглецеві ланцюги.
Зараз відомі члени ряду з більш ніж 100 атомами вуглецю.
Вуглеводні від метану до бутану при нормальних умовах газоподібні. Починаючи з пентану, у якого п'ять атомів вуглецю, вони представляють собою рідини. Сполуки, що містять 17 і більше атомів вуглецю, при кімнатній температурі є твердими речовинами.
Вуглеводні метан, етан, пропан, бутан і т. Д. Утворюють ряд з'єднань, дуже близьких один до одного за будовою і хімічними властивостями. У таблиці "Ряд алканів" вказані назви та формули найважливіших членів цього ряду. Очевидно, що кожне наступне речовина відрізняється за складом від попереднього наявністю додаткової групи СН2.
Нового загальна формула вуглеводнів з n атомами вуглецю Сn Н2N +2. Таким чином, число атомів водню в молекулі на 2 більше, ніж подвоєне число атомів вуглецю. Ці два додаткових атома водню знаходяться по кінцях вуглецевого ланцюга. Такий ряд з'єднань називається гомологічних поруч.
Назви окремих членів наведеного ряду вуглеводнів закінчуються суфіксом "ан", і всі разом вони називаються алканами.
ряд алканів
Рідкі і тверді алкани містяться головним чином в нафти, а також в смолі, отриманої з бурого вугілля. Алкани переважно з шістьма - десятьма атомами вуглецю, наприклад октан, входять до складу бензину. Наступні за ними в ряду рідкі алкани - головна складова частина дизельного палива і мастил. Суміш твердих вуглеводнів цього ряду отримала назву парафін.
Відомі алкани не тільки з прямою, але і з розгалуженою вуглецевим ланцюгом.
Наприклад, для вуглеводню С4 Н10 можливі два варіанти будови.
Для наступного за ним вуглеводню С5 Н12 можливі вже три структури:
У алканах все вільні валентності атомів вуглецю насичені атомами водню. Тому їх називають ще насиченими вуглеводнями, На відміну від них, ненасичені вуглеводні містять менше водню. Вільні валентності сусідніх атомів вуглецю взаємодіють в них один з одним і утворюють подвійні або потрійні зв'язки.
У структурних формулах такі відношення зображують двома або трьома рисками між відповідними атомами вуглецю. Очевидно, що ненасичені вуглеводні, якщо розташувати їх в порядку збільшення числа атомів вуглецю, теж утворюють гомологічні ряди.
Найпростіші і в той же час найбільш важливі в техніці ненасичені вуглеводні мають в молекулі одну подвійну або потрійну зв'язок. У першому випадку вони називаються алкенами. а в другому - алкінілу.
Перші представники цього ряду - етен (етилен) (Н2 С = СН2) і Етін (ацетилен) (НС≡СН). Етен і Етін є найважливішими проміжними продуктами в технології органічного синтезу. Обидва ці газу в даний час проводяться в усьому світі у величезних кількостях шляхом каталітичної переробки вуглеводнів нафти. Крім того, велике значення має спосіб отримання Етін з карбіду кальцію і води.
Вивчення властивостей ненасичених вуглеводнів почнемо з етена, який легко можна отримати зі спирту і сірчаної кислоти.
Зберемо простий прилад. Для цього знадобляться дві пробірки. До однієї з них підберемо пробку з двома отворами і вставимо в неї вигнуту скляну трубку і термометр зі шкалою до 250 ° С. Всі з'єднання повинні бути досить щільними, щоб утворюється газ міг виходити тільки через трубку.
В пробірку помістимо 2 мл денатурованого спирту і обережно, малими порціями, додамо 5 мл концентрованої сірчаної кислоти (тільки в захисних окулярах!). При цьому суміш дуже сильно розігріється, і ми відразу ж відчуємо приємний запах - це виділяється етен, поки в малій кількості. Можна додати в пробірку ще 1-2 г дрібного чистого піску, щоб прискорити реакцію. Однак можна цього і не робити.
У другу пробірку наллємо 5-10 мл 10% -ного розчину соди (карбонату натрію) і додамо кілька крапель розчину перманганату калію. Розчин повинен вийти інтенсивно фіолетовим, але не занадто темним. Він називається реактивом Байєра. (У вітчизняній хімічній літературі спосіб визначення будови ненасичених сполук шляхом їх окислення розведеним розчином перманганату калію отримав назву реакції Вагнера. Ця реакція була відкрита Е.Е. Вагнером в 1887 році і описана в "Журналі Російського фізико-хімічного товариства" за 1888 г. т . 20, стр. 72 - Прим. перекл.)
Тепер зберемо прилад і будемо нагрівати першу пробірку пальником Бунзена до тих пір, поки термометр, занурений в суміш спирту з сірчаною кислотою, що не покаже 150-170 ° С.
За скляній трубці відводиться газоподібний етен (тепер ми легко впізнаємо його по приємному запаху). Припустимо його через реактив Байєра. Незабаром розчин знебарвиться і одночасно виділяться коричневі пластівці оксиду марганцю (IV).
Якщо знайдеться небагато бромної води, можна розбавити її водою в співвідношенні 1: 1 і через отриману буру рідину пропустити етен. (Обережно! Пари брому діють на очі і дихальні шляхи). Забарвлення бромної води зникне. Після цього можна підпалити етен, все ще виділяється з вигнутою скляної трубки. Він горить світиться, злегка коптить полум'ям.
Ненасичені вуглеводні, на противагу насиченим, легко вступають в хімічні реакції. Так, в нашому досвіді етен окислявся киснем з перманганату калію, а перманганат калію при цьому відновлювався. Так само, як правило, ведуть себе по відношенню до реактиву Байєра і інші ненасичені вуглеводні. Реакційна здатність цих речовин пояснюється тим, що їх подвійні або потрійні зв'язки розщеплюються з утворенням простих зв'язків. При цьому за рахунок вільних валентностей приєднуються атоми або групи атомів, наприклад кисень або бром.
Застосування етена і Етін (ацетилену) в промисловості обумовлено тим, що, на відміну від алканів, вони мають високу реакційною здатністю. Саме завдяки їй на основі етена і Етін можна побудувати безліч різних органічних сполук.
Більшість органічних сполук складається переважно з вуглецю і водню.
Вже знайомі нам вуглеводні містять тільки ці два елементи. В інших же органічних сполуках, з багатьма з яких ми познайомимося пізніше, містяться ще один або кілька інших елементів, найчастіше кисень, галогени (хлор, бром, йод), азот і сірка.
Наведені нижче прості досліди в багатьох випадках придатні для якісного визначення азоту, галогенів і сірки.
Щоб з'ясувати, чи є в речовині азот, пробу гріють в пробірці з надлишком натронной вапна.
Якщо її немає, можна замінити її сумішшю гідроксиду натрію (їдкого натру) з надлишком негашеного вапна. Простежимо тільки, щоб у верхній частині пробірки не залишилося пристали частинок вапна.
Заткнемо пробірку шматочком вати, а на нього покладемо зволожену смужку червоного лакмусового паперу. Пробірку нагріємо на пальнику Бунзена (маленьким полум'ям) - спочатку слабо, потім сильніше.
Синє забарвлення індикаторного паперу вказує на присутність азоту. Визначення грунтується на тому, що міститься в органічних речовинах пов'язаний азот при нагріванні з натронной вапном (або ще по одному способу - з концентрованої сірчаної кислотою) у багатьох випадках перетворюється в аміак.
У багатьох випадках галогени в органічних сполуках можна виявити за допомогою проби Бейльштейна. Візьмемо не дуже тонку мідний дріт без ізоляції, зачистили її і загнемо один кінець петелькою. В петлі зміцнимо шматочок пористої кераміки ( "кипелку").
Прожарити цей кінець дроту в несвітними зоні полум'я пальника, поки не зникне зелене забарвлення полум'я.
Потім погрозами петельку в досліджувану рідину або помістимо на неї пробу твердого речовини. Якщо тепер знову внести дріт в несвітними зону полум'я, то присутність галогену виявляється по зеленому (йод) або блакитно-зеленому (хлор, бром) фарбування полум'я.
Правда, ця проба дуже чутлива. Тому часто галоген виявляється навіть в тому випадку, коли досліджувана речовина забруднено малим кількість містить галоген домішки. Деякі сполуки (мурашина і бензойна кислоти, різні неорганічні речовини) заважають визначенню, так як вони самі забарвлюють полум'я в зелений колір.
Для виявлення сірки зазвичай прожарюють пробу з металевим натрієм. При цьому сірка переходить в сульфід, який виявляють за допомогою нітропрусиду натрію. Ми виберемо інший спосіб, щоб обійтися без важкодоступного і небезпечного натрію.
На кінчику шпателя візьмемо пробу досліджуваного речовини і помістимо її в маленьку порцелянову чашку. Додамо трохи концентрованої або краще димить азотної кислоти і сильно нагріємо чашку. Робити це потрібно в витяжній шафі або на відкритому повітрі. При цьому кислота випаровується. До залишку ще раз додамо азотну кислоту і знову випарується. Розчинний залишок у воді і при необхідності Отфильтруем розчин. Якщо в пробі досліджуваного речовини містилося сірка, то при змішуванні отриманого розчину з розчином хлориду барію випаде осад нерозчинного сульфату барію.
Читальний зал кунсткамери: що тут є?