Науковий центр серцево-судинної хірургії ім. А. Н. Бакулева РАМН, Москва
ЕФД
У всіх пацієнтів для проведення картування і вивчення механізмів формування ФП використовували чотири багатополярним електрода. В вінець синус доступом через ліву підключичну вену вводили десятіполюсний електрод фірми "Biosense Webster", США. Картування і стимуляцію ЛП і ЛВ здійснювали після транссептальной пункції міжпередсердної перегородки в області овальної ямки голкою Брокенбурга. Голку для пункції проводили через інтродюсер шляхом пункції правої стегнової вени. Після транссептальной пункції за допомогою одного або двох інтродюсеров Preface 8F (фірма "Biosense Webster", США) в ЛП проводили іригаційний охолоджуваний катетер Thermo-cool 7F ( "Biosense Webster", США) для стимуляції і радіочастотної ізоляції ЛВ. Для запису потенціалів з периметра ЛВ використовували циркулярний керований 10- або 20-полюсний електрод - катетер Lasso і Lasso 2515 фірми "Biosense Webster", США (рис. 2). У всіх хворих визначали діаметр гирла і анатомію ЛВ шляхом селективної ангіографії ЛВ і порівнювали їх з даними тривимірної КТ ЛВ. Відразу після транссептальной пункції внутрішньовенно вводили гепарин в дозі 0,5 мг на 1 кг маси тіла з подальшою його титрацією і підтриманням рівня АСТ> 300.
Аритмогенной вважали ЛВ, в якій була зареєстрована одинична або залпова ектопічна активність, в тому числі з "запуском" епізодів ФП або тріпотіння передсердь (рис. 3). На синусовом ритмі у всіх хворих при реєстрації потенціалів по периметру усть ЛВ визначали подвійний або багатокомпонентні спайки. Перший (низькочастотний) спайк відбивав активність стінки ЛП, а другий (високочастотний) був власне Спайком електричної активності м'язової муфти ЛВ. У тому випадку, якщо потенціал (спайк) ЛП і ЛВ важко було диференціювати, проводили стимуляцію правого передсердя і дистальних відділів вінцевого синуса, що дозволяло чітко диференціювати потенціали ЛВ і ЛП. Під час ектопічної активності з ЛВ відзначена зворотна послідовність активації: першим реєструвався високочастотний потенціал ЛВ, а потім - низькоамплітудних і низькочастотний потенціал прилеглого до гирла ЛВ ЛП.
У всіх випадках (вивчені 1263 ЛВ) проведено циркулярний картування вен шляхом переміщення катетера Lasso з гирла в дистальні відділи ЛВ до зникнення електричної активності і, таким чином, визначали розміри м'язових муфт ЛВ. У перших 14 пацієнтів Мірча проводили на відстані 5-7 мм від гирла ЛВ, причому у 2 пацієнтів проводили абляцию тільки ектопічного вогнища, а у інших - ізоляцію ЛВ по всьому периметру. У 230 хворих РЧ ізоляцію легеневих вен проводили в гирлі ЛВ, чітко в області їх впадання в ЛП. РЧ-вплив на синусовом ритмі або при стимуляції вінцевого синуса починали в області найбільш ранньої активації муфти ЛВ, яку поділяли на 12 секторів (за годинниковою стрілкою). У кожному разі домагалися повної електричної ізоляції ЛВ від решти ЛП (рис. 4, 5).
Для РЧ-абляції використовували аблятора Atakr II і Stockert (США) з максимально встановлюється температурою 50 ° С і енергією від 20 до 38 Вт. Для іригаційних катетерів максимальна температура не перевищувала 40-41 ° С при потужності впливу 20-38 Вт і потоці фізіологічного розчину через дистальний (зрошувану) полюс електрода 17 мл / хв. В ефективної точці час РЧ-аплікації становило 45-60 с. Після електричної ізоляції всіх ЛВ порівнювали їх електрофізіологічні властивості (ефективний, функціональний рефрактерний періоди, фрагментовану активність, час проведення імпульсу в легеневій вені, можливість індукції ФП / ТП в ізольованій вені) до- та після процедури. Після процедури пацієнт продовжував приймати варфарин протягом 3 міс, після чого проводили СКТ і ПП ЕхоКГ.
У 54 пацієнтів з хронічною формою ФП (60 операцій) картування і РЧ-абляцию проводили з використанням нефлюороскопіческой (магнітна) системи картування CARTO ( "Biosense Webster", США) з використанням іригаційних катетерів NAVI-STAR Thermo-Cool, 7F ( "Cordis- Webster ", США). Система CARTO дозволяла в реальному масштабі часу реєструвати електричні потенціали, визначати час активації передсердь, амплітуду сигналу і в тривимірному просторі локалізувати положення Картира електрода. Бі і уніполярні сигнали реєстрували з керованого електрода, а референтним електродом служив катетер, розташований в вінцевій синусе. Протягом 10-15 хв без використання флюороскопии проводили тривимірну реконструкцію ЛП і ЛВ. Система CARTO працювала з традиційною системою для реєстрації електричних сигналів (64 канали) і стимуляції серця ( "Prucka Engineering", США або "Елкарт", "Електропульс", Росія). Проводили реєстрацію 4-12 відведень ЕКГ і одночасно до 32 каналів електрограм (ЕГ).
Після процедури Мірча ЛВ реєстрували 12 відведень ЕКГ, проводили холтерівське моніторування (багаторазово), трансторакальну і ПП ЕхоКГ. Через 3-12 міс повторювали контрастну СКТ для виявлення можливих стенозов ЛВ. Значним вважалося звуження гирла ЛВ и 50%. Всі пацієнти отримували протягом 3 міс варфарин під контролем МНО. За свідченнями призначали антиаритмічні препарати ІС класу. Термін спостереження склав від 1 до 65 міс, в середньому - 15 ± 11,4 міс.
Статистичну обробку отриманих даних здійснювали методом варіаційної статистики за допомогою спеціальних комп'ютерних програм. Достовірність відмінностей порівнюваних величин визначали за критеріями Стьюдента, Фішера і достовірної ймовірності - p. Статистично значущим вважалося значення p<0,05.
Результати та обговорення
Застосування нових електродів і систем для РЧ-абляції, в тому числі з використанням іригаційних систем, дозволило отримати позитивні результати лікування у 87% хворих в терміни спостереження до 5 років. Даний підхід до радикального лікування ФП шляхом усунення пускових механізмів - тригерів в ЛВ ефективний при так званих пароксизмальних "ектопічних" надшлуночкових тахікардій (НЖТ) і ФП, коли розміри, а точніше обсяг ЛП не перевищує нормальних значень. У хворих з персистентной (стійка) і тим більше на хронічну форму ФП поряд з ізоляцією ЛВ ми використовували лінійну Мірча в області лівого нижнього перешийка серця або модифіковану ендокардіальний процедуру "Лабіринт", так як ЛП у даної групи пацієнтів відіграє домінуючу роль в підтримці ФП [5 ].
Клінічна характеристика хворих з ФП
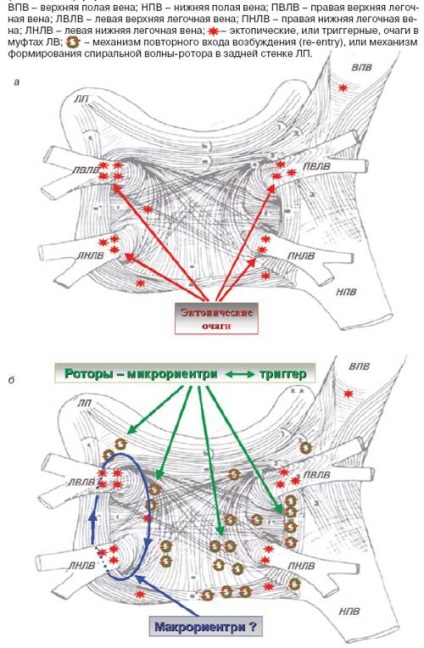
Мал. 1. Анатомічна будова ЛВ, що впадають в ЛП, і механізми ФП. а -
пароксизмальна (ектопічна) форма, б - персистентная або хронічна
(Постійна) форма.
Мал. 2. Інвазивне ЕФД ЛВ з використанням керованого циркулярного електрода - катетера Lasso (розташований в ЛВЛВ).
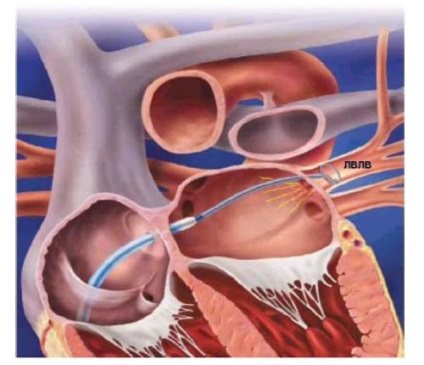
Схема 1. Алгоритм радикального лікування ФП, рефрактерною до ААТ (пароксизмальна форма).
Мал. 3. Виникнення ФП при появі ектопічної активності в ЛВЛВ.
1-3 - відведення ЕКГ; 4 - Картира електрод, розташований в правій верхній легеневої вені (ПВЛВ); 5-14 - біполярні електрограми, зареєстровані з 20-полюсного катетера Lasso, встановленого в ЛВЛВ; 15 - біполярна ЕГ з області вінцевого синуса (ВС). Стрілкою (канал 12) зазначено момент "запуску" ФП.
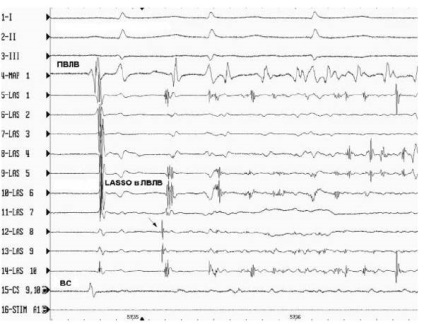
Схема 2. Алгоритм радикального лікування ФП, рефрактерною до ААТ (персистуюча форма).
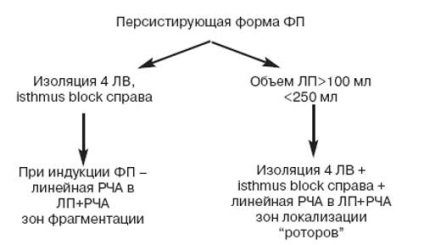
Схема 3. Алгоритм радикального лікування ФП, рефрактерною до ААТ (хронічна форма).
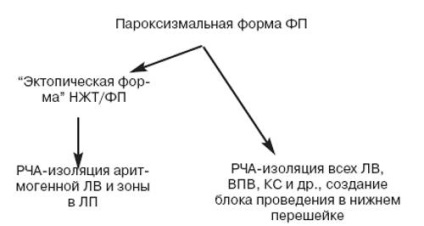
Мал. 4. Результати РЧ-ізоляції аритмогенной ПВЛВ. У пацієнта відзначено відновлення синусового ритму на ЕКГ (відведення I, II, III, V1 і CS1, 2). В ЛВ зберігається ФП (Lasso 1-10).
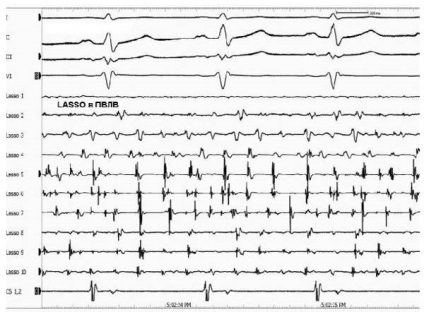
Мал. 5, а, б. Схема ізоляції ЛВ з використанням катетера Lasso 2515 і зрошуваного електрода для Мірча (зірочки - області абляції м'язових муфт в ЛВ).
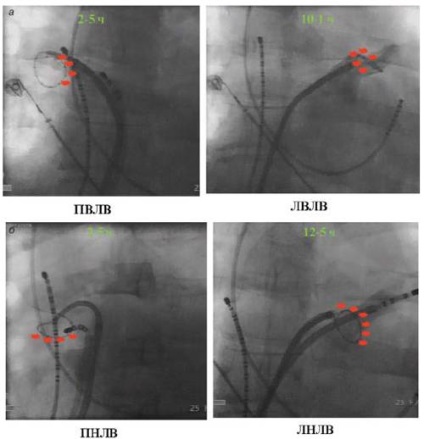
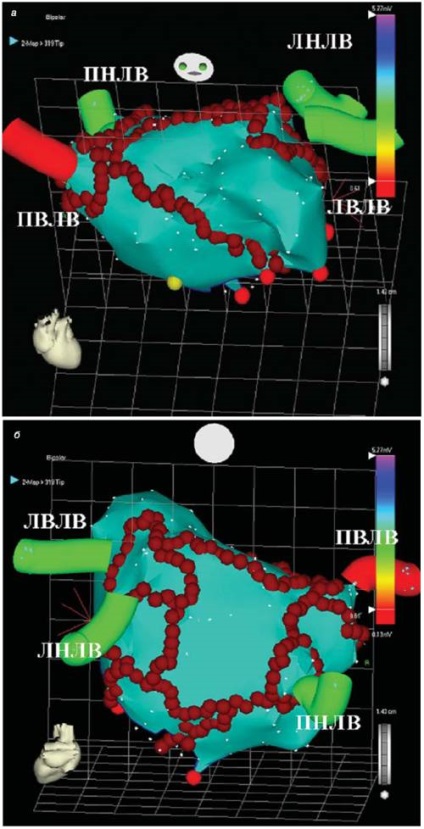
Мал. 6. Методика лінійної Мірча з використанням нефлюороскопіческой магнітної системи картування CARTO. а - вид спереду, б - вигляд ззаду.
Представлена схема модифікованої процедури "Лабіринт" з ізоляцією ЛВ у хворого з хронічною формою ФП (точками відзначені зони РЧ-абляції).
У нашому дослідженні методом Мірча були ізольовані один тисячу двісті шістьдесят три ЛВ: 351 права верхня ЛВ (ПВЛВ), 311 лівих верхніх ЛВ (ЛВЛВ), 277 лівих нижніх ЛВ (ЛНЛВ) і 269 правих нижніх ЛВ (ПНЛВ). У 6 випадках електрично ізолювали гирлі верхньої порожнистої вени, в м'язової муфти якої локалізувався ектопічний вогнище. Основний принцип абляції складався в повній електричної ізоляції ЛВ, що виключало поширення електричної активності, в тому числі ектопічної, з ЛВ в ЛП. Використання циркулярного катетера Lasso, перш за все його нової моделі - Lasso 2515 З мінливих діаметром, дозволило відповісти на ряд питань, що стосуються клінічної електрофізіології ЛВ і пароксизмальної ФП: 1) ектопічна активність в 72% випадків відмічена в верхніх ЛВ, що певною мірою пов'язано з їх великим діаметром, великою довжиною м'язових муфт (від 1,5 до 3 см); 2) поряд з ектопічної активністю, яка запускає і підтримує пароксизми ФП і тріпотіння передсердь (ТП), механізм повторного входу (re-entry) - роторної активності в ЛВ також є важливим електрофізіологічних механізмом формування, а головне підтримки ФП; 3) при РЧ-ізоляції верхніх ЛВ від 72 до 88% хворих потребує абляції від 60 до 100% периметра усть легеневих вен. Останнє спостереження ще раз підкреслює різну анатомічну організацію м'язових муфт, що з використанням кругових багатополярним катетерів дозволяє зменшити час Мірча з 15 до 7-10 хв. Використовувані параметри РЧ-впливу дозволили виключити в нашій серії досліджень формування стенозів в 30% ЛВ і більш. Важливо підкреслити, що застосування інших методів абляції в ЛВ, в тому числі з використанням великої енергії впливу в середніх і дистальних відділах ЛВ, супроводжується стенозами від 7 до 42% випадків, в середньому 11%, що в ряді випадків вимагає виконання балонної ангіопластики і стентування ЛВ [3, 7, 8]. Електрично ізольовані аритмогенні ЛВ відрізнялися трьома видами електричної активності: 1) в ЛВ зберігалися епізоди електричної активності, рідкісного ритму або ФП або ТП - 30% випадків; 2) відсутня електричні активність після процедури Мірча у 70% хворих, як правило, в нижніх ЛВ; 3) аритмогенні, в тому числі ізольовані від ЛП, ЛВ мали достовірно більш менші значення функціонального (190 ± 60 мс) і ефективного (215 ± 70 мс) рефрактерних періодів в порівнянні з неарітмогеннимі ЛВ і ЛП. Декрементное проведення та індукція ФП відзначені в 20 разів частіше в групі хворих з ФП у порівнянні з контрольною групою, в тому числі в неарітмогенних венах (p<0,02). В настоящее время процент повторных вмешательств в нашей серии исследований, как и у других зарубежных исследователей, составил 35 [9]. Это связано с использованием щадящих режимов РЧА устьев ЛВ, что позволило нам добиться стенозов ЛВ не более 15% в отдаленные сроки. Предпочтительным методом абляции является ирригационная и холодовая РЧА с использованием специальных орошаемых катетеров. Мы также не отметили различий в проведении РЧА и ее эффективности на синусовом ритме либо ФП. Обязательным условием проведения процедуры на фоне ФП является электрическая изоляция на первом этапе процедуры наиболее аритмогенной вены (как правило, верхних ЛВ).
Застосування системи CARTO в 24 випадках у хворих з хронічною ФП дозволило ефективно усунути аритмію і зберегти синусовий ритм в терміни від 2 до 4 років (рис. 6).
В даний час в декількох клініках світу отримані зіставні результати ефективності лікування хворих з пароксизмальною і персистентной формами ФП, рефрактерними до антиаритмічної терапії (ААТ). Позитивний результат, тобто стабільний синусовий ритм після операції, відзначений у 50-70% хворих без прийому ААТ і майже у 80-86% на тлі прийому раніше неефективних антиаритмічнихпрепаратів [10-13].
Таким чином, використання нових технологій при електрофізіологічне діагностиці ФП дозволяє визначити механізми формування та підтримки аритмії, виявити так звані аритмогенні ЛВ. М'язові муфти ЛВ мають специфічні електрофізіологічні властивості, що визначають умови для формування пароксизмальної форми ФП. Крім електричної ізоляції ЛВ при процедурі Мірча (особливо в області задньої стінки ЛП) відбувається часткова (парасимпатична) денервация серця, що також впливає на ефективність інтервенційного лікування ФП. Сучасні методи інтервенційного лікування дозволяють радикально усунути пароксизмальную форму ФП у 85-90% хворих шляхом РЧ-ізоляції легеневих вен. Застосування лінійної РЧ-абляції і варіантів процедури "Лабіринт" з використанням нефлюороскопіческой системи картування CARTO дозволяє успішно усунути стійкі і хронічні форми ФП при обсягах ЛП до 180 мл, що визначаються методом контрастної СКТ. На підставі результатів ЕФД механізмів ФП і результатів інтервенційного і хірургічного лікування різних форм ФП пропонуємо наступний алгоритм лікування ФП, рефрактерною до профілактичної ААТ (схеми 1-3). У найближчому майбутньому необхідно проведення рандомізованих досліджень для підтвердження ефективності інтервенційних методів лікування ФП, вибору оптимального методу абляції субстрату аритмій і впровадження методу в широку клінічну практику провідних арітмологіческіх центрів країни.