Сторінка 15 з 92
Можна не сумніватися, що імунна система «річ хороша», проте як наймана армія вона може обернутися проти свого господаря.
Так, незвично сильну імунну відповідь або постійний вплив чужорідних антигенів можуть привести до пошкодження тканин і реакцій гіперчутливості. Прикладами служать: алергія на пилок рослин; патологія крові, пов'язана із застосуванням деяких ліків; гломерулонефрит, викликаний утворенням імунних комплексів; хронічний гранулематоз при туберкульозі або шистосоматоз.
В інших випадках порушується толерантність до нормальних антигенів власного організму, що призводить до різних аутоімунних захворювань, наприклад тиреотоксикозу, міастенії, багатьом ревматологическим захворювань.
Ще один приклад імунопатологічних реакцій - відторгнення трансплантата, коли антигени МНС донора викликають сильну реакцію у реципієнта. І нарешті, необхідно торкнутися стану імунодефіцитних, яке зустрічається не так рідко і проявляється в неадекватному функціонуванні імунної системи. Мабуть, для читача вже очевидно, що головні проблеми при імунодефіцитних пов'язані з персистуючою інфекцією, за своїм характером залежить від того, який елемент імунної системи не функціонує в конкретному випадку.
висновок
Існує широкий спектр механізмів природженого імунітету, ефективність яких при повторному контакті з антигеном не підвищується. Мікроорганізмам важко проникнути в організм людини завдяки захисній дії шкіри, слизу, роботі війок, вимиваються дії бактерицидних рідин (наприклад, сліз), високій кислотності шлункового соку і мікробного антагонізму. Якщо бактерії все-таки подолали всі ці бар'єри, вони руйнуються розчинними факторами, наприклад лізоцимом, або шляхом фагоцитозу з подальшим внутрішньоклітинним переварюванням.
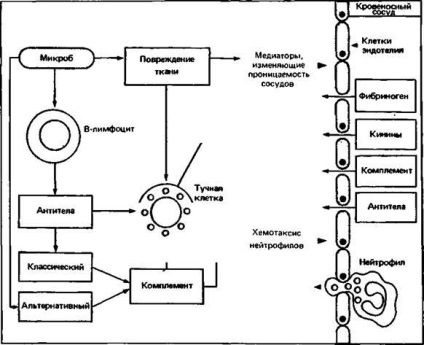
Мал. 2.17. У відповідь на пошкодження тканин мікробами (наприклад, бактеріальними токсинами) розвивається гостра запальна реакція в результаті активації комплементу по альтернативному шляху (1), або (2) за допомогою антителозависимой запуску класичного шляху активації комплементу або дегрануляції тучних клітин (для цього існують спеціальні антитіла) .
Основні фагоцитирующие клітини це поліморфноядерні нейтрофіли і макрофаги. Мікроби зв'язуються з їх поверхнею, активують процес поглинання і опиняються всередині клітин, де зливаються з цитоплазматичними гранулами. Потім в дію вступають численні кіслородозавісімие і кіслородонезавісімие бактерицидні механізми.
Система комплементу складається з великого числа компонентів; її активація є ферментативну каскадну реакцію і призводить до поглинання мікроорганізмів фагоцитами. Компонент комплементу, представлений в сироватці в найбільшої концентрації, а саме С3, розщеплюється конвертазой, яка утворюється з С3b (продукту розпаду С3) і фактора В. Пов'язаний з поверхнею мікроорганізму С3b набуває стійкість до руйнівній дії факторів Н і I. Подальша активація компонента С5 призводить до утворення невеликого пептиду С5а; залишився фрагмент молекули- С5b-зв'язується з поверхнею мікроорганізму і за участю компонентів С6-С9 формує мембраноатакующего комплекс, що підвищує проникність мембран що може привести до осмотическому лізису клітини-мішені. С5а-ефективний хемотаксичний фактор поліморфноядерних лейкоцитів; крім того, він збільшує проникність капілярів. С3а і С5а діють на огрядні клітини, забезпечуючи вивільнення медіаторів, таких, як гістамін і лейкотрієни В4, які впливають на проникність капілярів і хемотаксис нейтрофілів, а також і активують останні. Нейтрофіли зв'язуються з мікробами, покритими С3b, за допомогою поверхневих С3b- рецепторів. Приплив поліморфноядерних лейкоцитів і збільшення проникності судин викликають потужну антимікробну гостру запальну реакцію (рис. 2.17).
Інші механізми гуморальної захисту засновані на функціонуванні білків гострої фази (наприклад С-реактивного білка).
Вірусні інфекції піддаються лікуванню за допомогою інтерферонів, які блокують реплікацію вірусів. Великі зернисті лімфоцити з активністю нормальних кілерів знищують інфіковані вірусом клітини.
Багатьом великим паразитам не вдається влаштуватися в організмі потенційного господаря завдяки позаклітинного знищення, яке здійснюється еозинофілами, пов'язаними з С3b.
Молекула антитіла виникла як специфічний адаптор для зв'язування з тими мікроорганізмами, які запускають альтернативний шлях активації комплементу, або запобігають активацію фагоцитуючих клітин.
Антитіло утворює комплекс з антигеном за допомогою спеціального антигензв'язуючих центру. Константні ділянки молекул антитіл активують комплемент класичним шляхом (зв'язування С1
і освіту С4b2b-конвертази для розщеплення С3) і з'єднуються з рецепторами антитіл на поверхні фагоцитів. Цей додатковий шлях, який призводить до гострої запальної реакції, посилюється антитілами, сенсибилизирующими огрядні клітини (рис. 2.17).
Антитіла утворюються плазматичними клітинами, попередниками яких служать В-лімфоцити, кожен з яких запрограмований на синтез антитіл певної специфічності. Ці антитіла розташовані на поверхні клітин і виконують функції рецепторів антигену. Зв'язування антигену зі специфічним рецептором активує клітку і викликає проліферацію певного клону і в кінцевому підсумку формування антітелообразующіх клітин і клітин пам'яті. Іншими словами, антиген сам піклується про селекцію клону, який продукує спрямовані до нього антитіла. Збільшення числа клітин пам'яті після прімірованія забезпечує більш швидкий ефективний вторинний відповідь в порівнянні з первинним. Це явище лежить в основі вакцинації, яка передбачає використання нешкідливих форм інфекційного агента для первинної ін'єкції.
Інша популяція лімфоцитів, Т-лімфоцити, здійснює контроль за внутрішньоклітинними інфекціями. Як і В-клітини, кожна Т-клітина має специфічний рецептор (хоча він структурно і відрізняється від молекули антитіла), який розпізнає антиген. Освіта комплексу між Т-клітинним рецептором і антигеном викликає клональную експансію, що приводить до утворення ефекторних клітин і клітин пам'яті, функціонування яких лежить в основі специфічного набутого імунітету. Т-лімфоцит розпізнає антиген на поверхні клітини в комплексі з молекулами МНС.
Т-хелпери, що розпізнають антиген в комплексі з продуктами МНС класу II на поверхні макрофагів, секретують # 947; інтерферон, який активує макрофаги і сприяє ефективному знищенню внутрішньоклітинних паразитів. Цитотоксичні Т-лімфоцити розпізнають антиген і глікопротеїни МНС класу I на поверхні інфікованих вірусом клітин і знищують ці клітини до початку реплікації вірусу. Вони теж секретують # 947; інтерферон, який надає навколишнім клітинам стійкість до зараження вірусом (рис. 2.18).
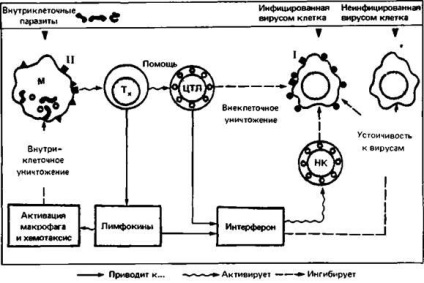
Мал. 2.18. Т-лімфоцити спільно з вродженими механізмами імунної системи борються з внутрішньоклітинної інфекцією. Молекули головного комплексу гістосумісності класів I і II (чорні квадрати) відіграють важливу роль при розпізнаванні поверхневого антигену Т-лімфоцитами. Т-хелпери (Тх) беруть участь у формуванні
цитотоксичних Т-лімфоцитів (ЦТЛ) з відповідних попередників. Бактерицидні механізми макрофагів (МФ) активуються лімфокінами. Інтерферон пригнічує реплікацію вірусів і стимулює нормальні кілери (НК), які разом з ЦТЛ знищують інфіковані вірусом клітини.
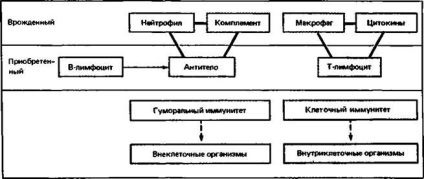
Мал. 2.19. Дві тріади, що об'єднують вроджений і набутий імунітет.
Хоча ефективність механізмів природженого імунітету не підвищується при повторному контакті з антигеном (на відміну від механізмів набутого імунітету), їх значення дуже велике, оскільки вони найтіснішим чином пов'язані з системою набутого імунітету в дві різні «тріади». Ці тріади складають чи не всю суть імунології. Антитіла, комплемент і поліморфноядерні лейкоцити забезпечують захист від більшості позаклітинних чужорідних агентів, а Т-лімфоцити, розчинні цитокіни і макрофаги від внутрішньоклітинних (рис. 2.19).
Різні імунопатологічні реакції (реакція гіперчутливості на екзогенні антигени, втрата толерантності до нормальних антигенів власного організму, що призводить до аутоімунних захворювань, і відторгнення чужорідного трансплантата) можуть призводити до пошкодження тканин. Імунодефіцитні певним чином знижує опір організму інфекціям.