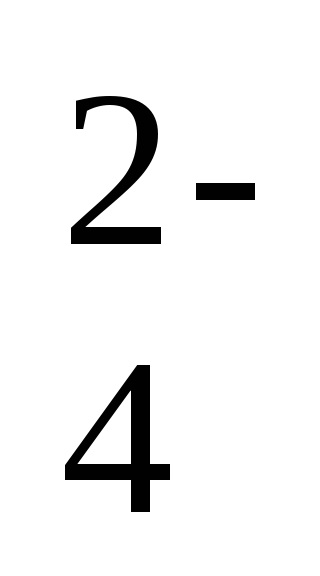Реакції в розчинах електролітів протікають між іонами, на які дисоціюють розчинені речовини. При цьому не змінюються ступені окислення елементів.
Не всі іонні обмінні реакції незворотні. Іонні обмінні реакції йдуть до кінця в тому випадку, якщо в результаті реакції утворюється:
-нерозчинний з'єднання, що випадає в осад;
-слабкий електроліт (вода, слабка основа або слабка кислота).
-- Рівняння реакцій такого типу більш правильно писати не в молекулярній, а в іонно-молекулярній формі. У цих рівняннях вказують іони, на які розпадаються молекули сильних електролітів. Малорозчинні речовини, що виділяються з розчину у вигляді осаду, газоподібні сполуки і слабкі електроліти в цих рівняннях пишуть в молекулярному вигляді. Крім того, існує коротка іонна форма запису рівняння реакції, що відображає сутність реакції, що протікає в розчині електроліту.
Приклади реакцій, що йдуть необоротно
1. Утворення осаду
- молекулярне рівняння реакції,
Ba 2 + 2Cl - + 2Na + + SO
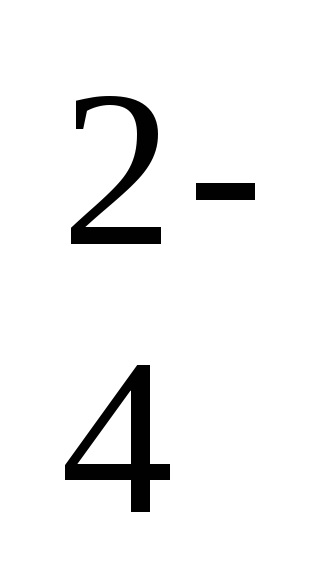
- іонно-молекулярне рівняння реакції,
Ba 2 + SO
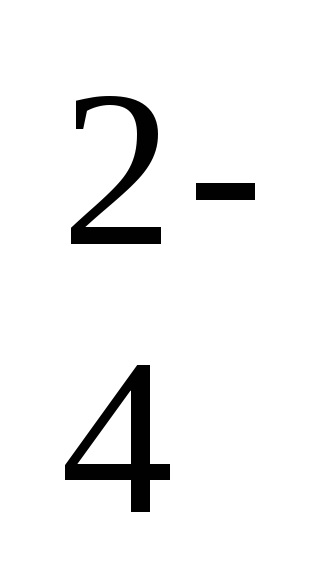
2. Освіта газоподібної речовини
- молекулярне рівняння реакції,
2Na + + S 2 + 2H + + 2Cl - = H2 S ↑ + 2Na + + 2Cl -
-іонно-молекулярне рівняння реакції,
2H + + S 2 = H2 S ↑ - коротка форма рівняння реакції.
3. Освіта слабкого електроліту
а) Води: 2NaOH + H2 SO4 = H2 O + Na2 SO4 - молекулярне рівняння реакції,
2Na + + 2OH - + 2H + + SO
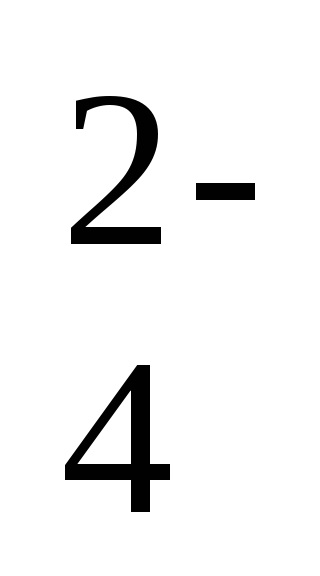
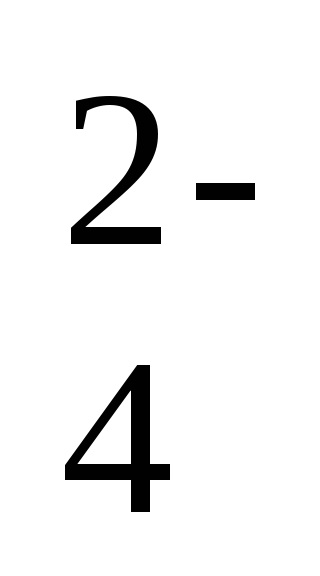
-іонно-молекулярне рівняння реакції,
2OH - + 2H + = 2H2 O - коротка форма рівняння реакції.
Реакція нейтралізації сильної кислоти сильною основою зводиться до взаємодії іонів водню з гідроксид-іонами.
б) Слабкою кислоти:
- молекулярне рівняння реакції,
2Na + + 2NO2 - + 2H + + SO
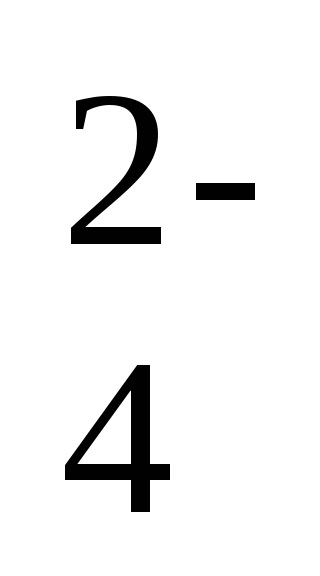
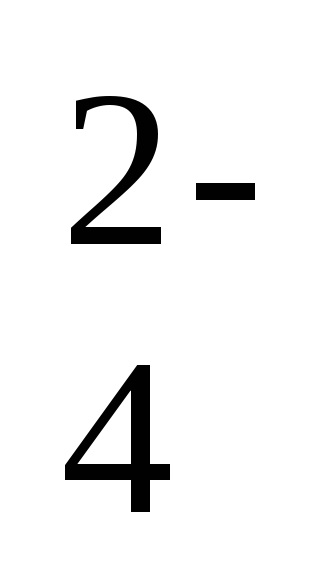
-іонно-молекулярне рівняння реакції,
2H + + 2NO2 - = 2HNO2 - коротка форма рівняння реакції.
Сильні кислоти витісняють слабкі кислоти з їх солей.
в) Слабого підстави:
NH4 Cl + NaOH = NH4 OH + NaCl
- молекулярне рівняння реакції,
NH4 + + Cl - + Na + + OH - = NH4 OH + Na + + Cl -
-іонно-молекулярне рівняння реакції,
NH4 + + OH - = NH4 OH - коротка форма рівняння реакції.
Сильні підстави витісняють слабкі підстави з їх солей.
амфотерні гідроксиди
Амфотерні гідроксиди - це нерозчинні компоненти типу Ме (ОН) n. які взаємодіють як з розчинами кислот, так і з розчинами лугів. Реагуючи з розчинами кислот, вони виявляють основні властивості:
Реагуючи з розчинами лугів, вони проявляють кислотні властивості, при цьому утворюються гідроксокомплексние з'єднання:
твір розчинності
Абсолютно нерозчинних речовин немає. Більшість твердих речовин володіють обмеженою розчинністю. У насичених розчинах електролітів малорозчинних речовин в стані динамічної рівноваги знаходяться осад і насичений розчин електроліту. Наприклад, в насиченому розчині сульфату барію, що знаходиться в контакті з кристалами цієї речовини, встановлюється динамічна рівновага: BaSO4 (т) ⇄ Ba 2+ (р) + SO
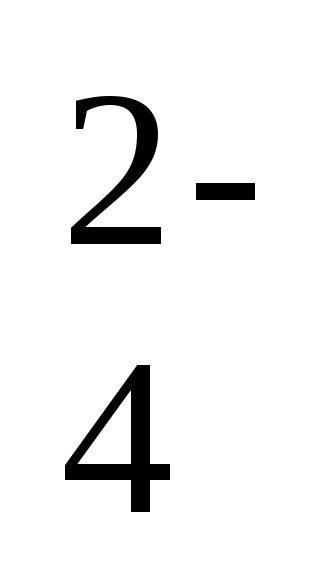
Для цього рівноважного процесу можна написати вираз константи рівноваги, враховуючи, що концентрація твердої фази не входить у вираз константи рівноваги: Kp = [Ba 2+] [SO
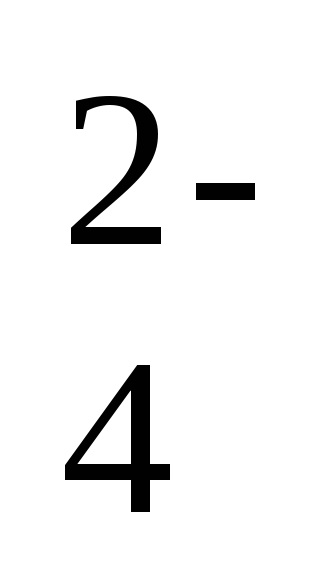
Ця величина називається твором розчинності малорастворимого речовини (ПР). Таким чином, в насиченому розчині малорастворимого з'єднання твір концентрацій його іонів в ступеня стехиометрических коефіцієнтів дорівнює величині твори розчинності. У розглянутому прикладі ПР (BaSO4) = [Ba 2+] [SO