Нітрати целюлози (НЦ) є енергетичної і структурної основою нітратцелюлозні порохів і твердих палив.
Нітратами целюлози називаються складні ефіри целюлози і азотної кислоти. Для виробництва нітратів целюлози застосовують целюлозу, яка міститься в бавовні, деревині, льоні, соломі і т. П. В кількості від 92-93% (бавовна) і до 50-60% (деревина). Для виготовлення високоякісної нітроцелюлози застосовують чисту целюлозу, що отримується із зазначеної сировини спеціальної хімічної обробкою.
Молекула целюлози складається з великого числа однаково побудованих і пов'язаних між собою глюкозних залишків С6Н10О5.
Тому загальна формула целюлози має вигляд (С6Н10О5) n, де n - число глюкозних залишків.
У кожному глюкозниє залишки є по три гідроксильні групи -ОН. Саме ці гідроксильні групи реагують з азотною кислотою за схемою:
,
де m = 1; 2 або 3.
Залежно від умов нитрации можуть заміщатися не всі гідроксильні групи, а тільки частина з них. З цієї причини виходить не одна, а кілька нітроцелюлозу різного ступеня етерифікації.
Будова целюлози можна виразити будь-якої певної формулою внаслідок того, що вона неоднорідна за величиною молекул. Ще в більшій мірі це відноситься до нітратів целюлози, які до того ж складаються з молекул, неоднорідних за ступенем етерифікації. Нітрати целюлози в залежності від вмісту азоту (ступеня етерифікації), розчинності в спіртоефірние суміші і від ступеня полімеризації практично класифікують на такі види: піроксилін № 1, піроксилін № 2, сумішеві піроксиліном марок ВА, СА, НА, піроколлодій, а також Колоксилини різних марок : Н, ВНВ, ПСВ, КП
13.Маркі піроксиліном, використовувані у виробництві пп. Чому не застосовують у виробництві однотипні піроксиліном, Колоксилин. Пояснити.
Будова целюлози можна виразити будь-якої певної формулою внаслідок того, що вона неоднорідна за величиною молекул. Ще в більшій мірі це відноситься до нітратів целюлози, які до того ж складаються з молекул, неоднорідних за ступенем етерифікації. Нітрати целюлози в залежності від вмісту азоту (ступеня етерифікації), розчинності в спіртоефірние суміші і від ступеня полімеризації практично класифікують на такі види: піроксилін № 1, піроксилін № 2, сумішеві піроксиліном марок ВА, СА, НА, піроколлодій, а також Колоксилини різних марок : Н, ВНВ, ПСВ, КП.
піроксилін № 2 повністю набухає в спіртоефірние суміші і частково утворює рідкий розчин. Піроксилін № 1 лише частково набухає в розчиннику, але, перебуваючи між сольватованих частинками піроксиліну № 2, стає рухомим, т. Е. Піроксилін № 1 і піроксилін № 2 взаємодіють не тільки з розчинником, а й один з одним. Встановлено, що розчинений піроксилін № 2 є більш ефективним пластифікатором для піроксиліну № 1, ніж спіртоефірние суміш.
Під розчинність НЦ мають на увазі кількість її, яке перейшло в розчин при обробці навішування (1 г) спіртоефірние сумішшю (150 мл)
з співвідношенням компонентів 1: 2 (за обсягом).
Зниження розчинності сумішевого піроксиліну внаслідок зменшення вмісту в ньому піроксиліну № 2 веде до скорочення витрат розчинника. Однак при дуже малому вмісті піроксиліну № 2 в суміші витрата розчинника також зростає. Це пов'язано з тим, що піроксилін № 1 погано пластифицируется спіртоефірние сумішшю, тому необхідно підвищувати активність спіртоефірние суміші шляхом збільшення в ній вмісту ефіру.
За Броунсу, найкращою пластичністю при одному і тому ж витраті розчинника мають среднеазотние піроксиліном з розчинністю близько 40%.
Основну роль в набуханні сумішевих піроксиліном грає піроксилін № 2. Одним з основних параметрів, що визначають поведінку піроксиліну № 2, є ступінь нитрации.
Пластифікатори нітратів целюлози. Якби нітрати целюлози були здатні ущільнюватися до щільності 1600-1670 кг / м3 (1,60-1,67 г / см3) і формуватися при пресуванні на закінчення, то порох можна було б виготовити з одного компонента - нітратів целюлози. Однак це неможливо. Це пояснюється відсутністю для нітратів целюлози властивості пластичності.
Вони є твердими речовинами волокнистої будови, пухкими, з великим числом макро - і мікропорожнеч, заповнених повітрям, і складаються з жорстких полярних макромолекул, пов'язаних між собою досить міцно різними силами (межпачечнимі і міжмолекулярними) і не здатних з огляду на це до переміщення одна відносно іншої. Вони не володіють термопластичностью навіть в області високих температур і знаходяться в застеклованном стані.
Загальна енергія зв'язку між макромолекулами по всій їх довжині може значно перевищувати енергію зв'язку між окремими ланками ланцюга. Тому відірвати одну молекулу від іншої настільки ж важко, як і розірвати макромолекули на окремі ланки.
Сумарна величина енергії міжмолекулярної взаємодії НЦ набагато перевершує величину енергії теплового руху ланок і сегментів ланцюгових макромолекул. При нагріванні НЦ руйнування хімічних зв'язків відбувається раніше, ніж сумарна ослаблення вторинних (міжмолекулярних і межпачечних) зв'язків виявиться достатнім для забезпечення умов переходу речовини зі склоподібного у високоеластичний і в'язкотекучий стан.
Було встановлено, що ні тиск, ні температура, ні тривалість обробки НЦ в формуючих пресах не можуть привести їх в пластичний стан. Отже, для того щоб надати НЦ такі властивості, які б визначали його плинність під впливом зовнішніх деформуючих зусиль, їх необхідно модифікувати.
Одним із способів модифікації НЦ є пластификация. Вона полягає у введенні в полімер різних рідин і твердих речовин (пластифікаторів) з метою полегшення його переробки, а також з метою поліпшення еластичності матеріалу і додання йому морозо- стійкості.
При пластификации змінюється в'язкість системи, збільшується гнучкість макромолекул і рухливість надмолекулярних структур. Для коллоксилина, піроколлодій, піроксиліну № 2, сумішевих піроксиліном хорошим пластифікатором є суміш етилового спирту з діетиловим ефіром. Слід зазначити, що в окремо етиловий спирт і діетиловий ефір не є пластифікаторами НЦ.
Найбільш ефективним пластифікатором всіх НЦ (від коллоксилина до піроксиліну) з найвищим ступенем етерифікації є ацетон і етилацетат. Нітрогліцерин, нітродігліколь є хорошими пластифікаторами коллоксилина. Додатковими пластифікаторами є динітротолуол, дибутилфталат.
При додаванні до піроксиліном відповідної кількості спіртоефірние суміші виходить маса, яка легко деформується під дією зовнішніх сил, але після зняття навантаження в початковий стан не повертається, т. Е. В системі має місце велика залишкова деформація через пластичної течії, яке, як відомо , завжди ускладнюється розвитком високоеластичної деформації.
15) Найбільш важливий простий, діетиловий ефір. формула якого має такий вигляд: (С2Н5) 2О або С4Н10О. Він являє собою безбарвну, прозору, дуже рухливу летючу рідину, що має своєрідний запах і пекучий смак. Під впливом світла, повітря, тепла і вологи ефір здатний розкладатися, утворюючи при цьому токсичні альдегіди, пероксиди та кетони, які дратують дихальні шляхи. При температурі води в 20 градусів розчиняється на 6,5%. Добре змішується з жирними та ефірними маслами, бензолом і спиртом, незалежно від співвідношення. Сам ефір, втім, як і його пари, легко запалюється. В певній пропорції з киснем або ж повітрям пари діетилового ефіру, використовувані для наркозу, вибухонебезпечні
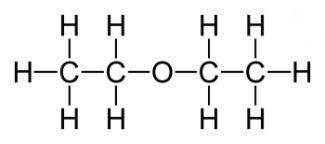
Хімічні властивості Для діетилового ефіру характерні всі хімічні властивості простих ефірів. Отже, розберемося з цим питанням докладніше. Це досить інертна речовина. Основна відмінність від складних ефірів - відсутність гідролізу, правда, є й винятки. На холоді не взаємодіє з хлоридом фосфору, металевим натрієм і багатьма розведеними мінеральними кислотами. Незважаючи на це, концентровані кислоти (сірчана і йодоводородная) навіть при низьких температурах розкладають ці ефіри, а нагрітий металевий натрій їх розщеплює. Ефір з неподіленими парами електронів взаємодіє з протоном сильної кислоти, в результаті чого утворюється нестійке оксоніевое з'єднання: - ацидолиз. Сірчана і йодоводородная кислоти, а також FeCl3 в ангідриді оцтової кислоти здатні розщеплювати прості ефіри. Хімічна реакція виглядає так: CH3-CH2-O-CH2-CH3 + HJ → CH3-CH2-OH + J-CH2-CH3. - Реакція металлірованія, що отримала назву реакції Шоригіна. Нагрітий металевий натрій розщеплює діетиловий ефір: C2H5-O-C2H5 + 2Na → C2H5ONa + C2H5Na - Відносна хімічна інертність не перешкоджає ефірів при зберіганні на повітрі утворювати перекису, що часто призводить до вибухів в кінці перегонки.
Діетиловий ефір: фізичні властивості Своєрідний запах, низька температура кипіння простих ефірів - свідоцтво слабкого міжмолекулярної впливу, а це говорить про низьку полярності і відсутності передумов до утворення водневих зв'язків. На відміну від спиртів ефірів притаманні сильніші електронодонорні властивості, що підтверджується значенням потенціалів іонізації. Посилення цих особливостей пов'язане з позитивним індуктивним ефектом групи атомів, які утворюються з алканів при видаленні атома водню.
Температура кипіння діетилового ефіру - 35,6 градуса за Цельсієм (це набагато нижче, ніж у ізомерних спиртів), а замерзання - 117 оС. Прості ефіри майже не змішуються з водою. Пояснення цьому досить просте: вони не здатні утворювати водневі зв'язки, оскільки їх молекули не мають полярних зв'язків. Погано розчиняється у воді і діетиловий ефір, щільність якого по відношенню до оксиду водню становить 0,714. Однією з особливостей даної речовини є схильність до електризації. Імовірність виникнення розрядів статичної електрики особливо висока при переливанні або зливі хімскладу, в результаті чого може статися запалення. Пари ефіру утворюють з повітрям, який в 2,5 рази легше, вибухові суміші. Нижня межа вибуховості - 1,7%, а верхній - 49%. Працюючи з ефіром, не слід забувати, що його пари мають властивість поширюватися на великі відстані без втрат здатності до горіння. Так що основна запобіжний захід - відсутність поблизу відкритого вогню та інших джерел займання. Простий ефір - малоактивне з'єднання, в рази менше реакційно в порівнянні зі спиртами. Чудово розчиняє більшу частину органічних речовин, завдяки чому використовується в якості розчинника. Винятком не є і діетиловий ефір. Фізичні властивості, так само як і хімічні, дозволяють застосовувати його в медицині і на виробництві
Отримання діетилового ефіру Прості ефіри в природі не зустрічаються - їх отримують синтетичним шляхом. Під впливом кислотних каталізаторів на етиловий спирт при підвищеній температурі виходить діетиловий ефір (формула вказана вище). Найпростіше отримати цю речовину за допомогою перегонки суміші, що складається з сірчаної кислоти і спирту. Для цього її необхідно розігріти до 140-150 градусів за Цельсієм. Нам знадобиться етиловий спирт і сірчана кислота (у рівних пропорціях), піпетки, пробірки й газоотводние трубки. Отже, після того як обладнання та реактиви підготовлені, можна приступати до проведення досвіду. В пробірку (вона обов'язково повинна бути сухою) необхідно налити 2-3 мл суміші спирту і кислоти і повільно нагріти. Як тільки почнеться кипіння, пальник забирається, а в гарячу суміш за допомогою піпетки по стінці пробірки додається від 5 до 10 крапель етилового спирту. Протікає реакція виглядає наступним чином: СН3-СН2-ОН (етілсерная кислота) + H2S04 СН3-СН2-OSO3H + Н2О; CH3-СН2-OSO3H + СН3-СН3-О; СН3-СН2-О-СН2-СН3 (діетиловий ефір) + Н2SO4. Про освіту діетилового ефіру свідчить з'явився запах.
Склад і формула Етанол - а саме так звучить одне з його офіційних назв - відноситься до простих спиртів. Він знайомий практично всім під тими чи іншими назвами. Часто його називають просто спиртом, іноді додають прикметники "етиловий" або "винний", хіміки можуть також назвати його метілкарбінолом. Але суть одна - С2Н5ОН.
Фізичні та хімічні властивості етанолу притаманні всі загальні характеристики і реакції спиртів. Він безбарвний, має характерні смаком і запахом. У нормальних умовах він рідкий, переходить в тверду форму при температурі -114 ° С, а кипить при +78 градусах. Щільність спирту етилового становить 0,79. Добре змішується з водою, гліцерином, бензолом і багатьма іншими речовинами. Легко випаровується, так що зберігати його потрібно в добре закритих ємностях. Сам є прекрасним розчинником, а також володіє відмінними антисептичними властивостями. Дуже горюча як в рідкому, так і в пароподібному стані. Етанол є психоактивних і наркотичною речовиною, входить до складу всіх спиртних напоїв. Смертельною дозою для дорослої людини є 300-400 мілілітрів 96% розчину спирту, спожитого протягом години. Ця цифра досить умовна, оскільки залежить від великої кількості факторів. Для дітей досить вже 6-30 мілілітрів. Так що етанол є і досить ефективним отрутою. Проте, він широко використовується, оскільки володіє рядом унікальних властивостей, що роблять його універсальним
Отримання діетилового ефіру Прості ефіри в природі не зустрічаються - їх отримують синтетичним шляхом. Під впливом кислотних каталізаторів на етиловий спирт при підвищеній температурі виходить діетиловий ефір (формула вказана вище). Найпростіше отримати цю речовину за допомогою перегонки суміші, що складається з сірчаної кислоти і спирту. Для цього її необхідно розігріти до 140-150 градусів за Цельсієм. Нам знадобиться етиловий спирт і сірчана кислота (у рівних пропорціях), піпетки, пробірки й газоотводние трубки. Отже, після того як обладнання та реактиви підготовлені, можна приступати до проведення досвіду. В пробірку (вона обов'язково повинна бути сухою) необхідно налити 2-3 мл суміші спирту і кислоти і повільно нагріти. Як тільки почнеться кипіння, пальник забирається, а в гарячу суміш за допомогою піпетки по стінці пробірки додається від 5 до 10 крапель етилового спирту. Протікає реакція виглядає наступним чином: СН3-СН2-ОН (етілсерная кислота) + H2S04 СН3-СН2-OSO3H + Н2О; CH3-СН2-OSO3H + СН3-СН3-О; СН3-СН2-О-СН2-СН3 (діетиловий ефір) + Н2SO4.