Для дослідження поведінки реального газу розглянемо ізотерми Ван-дер-Ваальса - криві залежності від при заданих температурах Т, які визначаються рівнянням Ван-дер-Ваальса для 1 благаючи газу (рис. 9.2). Ці криві розглядаються для чотирьох різних температур. При високих температурах ізотерма реального газу відрізняється від ізотерми ідеального газу тільки деяким спотворенням її форми, залишаючись монотонно спадає кривої. При деякій температурі на изотерме є точка перегину К. Ця ізотерма називається критичною, відповідна їй температура - критичною температурою. а точка К - критичною точкою. Стан з критичними параметрами називається критичним станом.
При температурах ізотерми мають хвилеподібний ділянку. У реальних ізотерм такого завитка немає, замість нього у них є прямолінійний горизонтальний ділянку (на рис. 9.2 позначені пунктиром). Якщо через крайні точки горизонтальних ділянок сімейства ізотерм провести лінію, то вийде колоколообразная крива, що обмежує область двофазних станів речовини. Ця крива і критична ізотерма ділять діаграму P, V під изотермой на три області: під колоколообразной кривої розташовується область двофазних станів (рідина і насичений пар Ж + П), ліворуч від неї знаходиться область рідкого стану (Ж), а праворуч - область пара ( П). Пар відрізняється від інших газоподібних станів тим, що при ізотермічному стисканні зазнає процес зрідження. Газ же при температурі вище критичної не може бути перетворений в рідину ні при якому тиску.
2. Метастабільні стану (грец. Meta - після, за, в даному випадку за стабільним станом, нестійкі стану).
Розглянемо частину ізотерми рис. 9.3. Стану на ділянці 2-3 не реалізуються, тому що на ньому . тобто збільшення обсягу газу супроводжувалося б не зменшенням, а зростанням тиску - абсолютно протиприродне властивість. На ділянках 1-2 і 3-4. це нормально, але виявляється, що ці стани не цілком стійкі. Досить в стані А попадання в пар порошинки, щоб речовина розпалася на дві фази і перейшло в стан В. (Нагадаємо, що фазою називається однорідна, однакова за властивостями частина системи. Наприклад, в закритій посудині вода і суміш повітря і пари води. Пар, знаходиться вравновесіі зі своєю рідиною називаетсянасищенним.
Тиск, при якому спостерігається рівновага, називається тиском насиченої пари). Стану, подібні станом А (нестійкі) називаються метастабільними. Стан 1-2, де тиск менше при даній температурі називається перегрітою рідиною. а 3-4
() - пересиченим паром. Розглянемо стан пересичені пара. Для освіти крапельок рідини необхідне зближення молекул на відстань близько відстані між молекулами в рідині. Для цього необхідна наявність центрів конденсації (порошинки, заряджені частинки, крапельки рідини). У камері Вільсона (англійський учений, лауреат Нобелівської премії 1927р.) Повітря, насичене парами води різко розширюється і, відповідно, охолоджується. Пари виявляються в стані перенасичення. Якщо заряджена частинка потрапить в камеру, то пар конденсується на ній в дрібні крапельки, утворюючи видимий слід ( «трек») при її русі.
Розглянемо перегріту рідину. Якщо рідина ретельно очистити від твердих включень, то шляхом нагрівання або зниження тиску до її можна перевести в стан перегріву. Проходження зарядженої частинки призводить до утворення уздовж сліду частки зародкових центрів кипіння. Бульбашки фотографують.
Розглянемо докладніше стан в т. К (рис. 9.2.). У цій точці відмінність в щільності рідини і насиченої пари повністю зникає. Одночасно зникає яке розрізнення між рідиною і парою. Межі розділу між рідиною і парою також немає. Перша і друга похідні тиску за обсягом дорівнюють нулю.
3. Внутрішня енергія реального газу. Крім кінетичної енергії включає потенційну енергію взаємодії молекул газу. Робота, що здійснюється при розширенні газу проти сил взаємного тяжіння молекул один до одного, дорівнює приросту енергії взаємодії. Ван-дер-Ваальса поправка до тиску. Тоді робота. звідси потенційна енергія
При реальний газ прагне до ідеального і тоді:
Раніше для кінетичної енергії хаотичного теплового руху молекул було отримано:.
Внутрішня енергія реального газу, що враховує і кінетичну і потенційну енергії:
Тобто внутрішня енергія благаючи Ван-дер-Ваальского газу є функція стану газу.
4. Ефект Джоуля-Томсона
Ефект Джоуля - Томсона полягає в зміні температури газу в результаті адіабатичного дроселювання - повільного протікання газу під дією постійного перепаду тиску через дросельний перешкоду (наприклад, пористу перегородку Др - дросель на рис. 9.4). Термін «адіабатичне» означає без теплообміну з навколишнім середовищем. Адіабатічность може бути здійснена, наприклад, за допомогою теплоізолюючих оболонки навколо каналу. при
переміщенні поршня (П) утворюється постійний перепад тиску (). Розрізняють а) позитивний ефект для Т. коли температура реального газу знижується і б) негативний ефект. коли (для ідеального газу T = const). Практичний інтерес представляє позитивний ефект. Позитивний ефект спостерігається в області тисків, де переважають сілипрітяженія
між молекулами. При розширенні молекули газу здійснюють роботу проти сил тяжіння і температура зменшується. При цьому кінетична енергія теплового руху газу витрачається на роботу проти сил молекулярного тяжіння.
Зміна температури може бути значним. Наприклад, повітря, розширюючись при кімнатній температурі від тиску 200 атм до тиску 1 атм охолоджується приблизно на 40.
Процес використовується в техніці для скраплення газів. На ефекті Джоуля - Томсона заснована робота так званої машини Лінде.
Скраплення газів і отримання низьких температур
Газ може бути перетворений в рідкий стан, якщо його температура нижче критичної і нижче температури кипіння при даному тиску.
Машина Лінде (німецький учений) (Рис. 9.5)
Атмосферне повітря стискається компресором (К) до тиску 220 атм. Стисле повітря проходить по трубопроводу і охолоджується проточною водою до 10 15. Далі повітря надходить у внутрішній канал
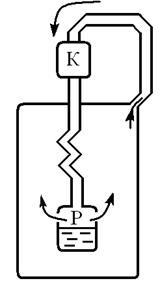
змійовика звідки в резервуар (Р), де тиск 20 атм. При цьому повітря охолоджується на 50. (Розширення відбувається в області позитивного ефекту Джоуля - Томсона). Охолоджене повітря по зовнішньому каналу змійовика відводиться до компресора, охолоджуючи наступні порції повітря, що йдуть по внутрішньому каналу і т.д. При температурі 180 і тиском 20 атм. починається конденсація повітря. Рідке повітря стікає в резервуар.
Турбодетандер Капіци (російський вчений, лауреат Нобелівської премії, 1894 - 1984). Газ, стислий компресором (К) до тиску 6-7 атм, надходить в турбіну (Т), розширюється до тиску 1,3 атм. здійснює роботу, охолоджується, далі охолоджує газ, що надходить в компресор, циркулює і т.д. і, нарешті, вони вбирають. Таким методом можна отримати рідкі азот, кисень, водень, гелій. (Відзначимо, що температура кипіння рідкого кисню 90К, азоту 78К, водню 20К, гелію 4,2К). Застосовуються рідкі гази в металургії, медицині, авіації.